Презентация на тему: Методика решения расчётных задач с неполным набором данных

Методика решения расчётных задач с неполным набором данных

Задача 1 Определить формулу кристаллогидрата фосфата натрия при условии, что массовая доля водорода в нем составляет 6, 316 %. Составим формулу кристаллогидрата фосфата натрия: Na3PO4 * n H2O Пусть взяли 100 г кристаллогидрата. Молярная масса кристаллогидрата: (164 + 18n) г/ моль

Составим пропорцию: 100г Na3PO4 * n H2O ---------------- 164 + 18n 6,316 г H --------------------------------- 2n Решим пропорцию: 200n = 6,216 * (164 + 18n), n =12 В результате формула кристаллогидрата фосфата натрия примет вид Na3PO4 * 12 H2O

Задача 2 Для получения сульфата калия рассчитанное количество карбоната калия растворили в 5% - серной кислоте. Определите массовую долю сульфата калия в полученном растворе. Запишем уравнение реакции: K2CO3 + H2SO4=K2SO4 + CO2 + H2O 1 моль 1 моль 1 моль 1моль

Пусть взяли 100 г раствора серной кислоты. Количество вещества серной кислоты: n (H2SO4)= 0,05* 100/98 =0,051 моль= = n (K2SO4)=n (K2CO3) = n (CO2) m(K2SO4)= 0,051 моль * 174 г/моль = 8, 9 г

m (р-ра) = m(K2CO3) + m (H2SO4)р-ра – m (CO2) = =0,051*138 + 100 - 0,051*44 =106,8г. ω(K2SO4)= m(K2SO4)/ m р-ра= =8,9 / 106,8=0,083 или 8,3%

Задача 3 Имеется смесь метаналя и водорода, которая на 25 % легче метана. Определите массовые доли газов в смеси Пусть смеси было 1 моль, тогда n (HCOH) = х моль, n (H2) = (1-х) моль. М ср. смеси = 0,75 * 16 = 12 г/моль

30 * x + 2 * (1-x) = 12 x = 0,3571 моль m (HCOH) = 0,3571 * 30 =10,7 г n (H2) = 0,6429 моль m (H2) = 0,6429 * 2 = 1,3 г Mсмеси = 10,7 + 1,3 = 12г ω (HCOH) = 10,7 / 12= 0,89 = 89 % ω (H2) = 11 %

Задача 4 К образцу чистой жжёной извести приливали воду до тех пор, пока его масса не увеличилась на 30%. Вся ли известь погасилась? CaO + H20 = Ca(OH)2 Пусть было n (CaO) = 1 моль ∆М = 74 – 56 = 18 (H20) ∆m = 56 * 0,3 = 16,8 г ∆m / ∆M = n(CaO) = 16,8 / 18 = 0, 93 моль m (CaO) = 0,93 * 56 = 52,3 г Ответ: не вся погасилась

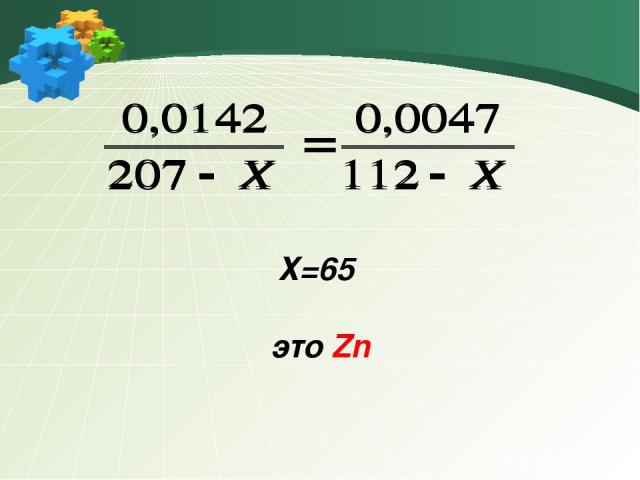
Задача 5 Две пластинки одного металла (II) с одинаковыми массами опустили в растворы солей свинца и кадмия равных молярных концентраций . По окончанию реакций масса первой пластинки увеличилась на 1,42 %, а второй - на 0,47 %. Определите из какого металла была пластинка. Пусть М (Ме) = х г/ моль

1)Ме + Pb +2 = Ме +2 + Pb х г 207г ∆М1 =208 – х 2) Ме + Cd +2 = Ме +2 + Cd х г 112 г ∆М2 = 112 – х

Пусть масса пластинки 1 г ∆m1 = 0,0142г ∆m2 = 0,0047г n = ∆m/ ∆М Масса пластинок одинакова n1 =n2

Х=65 это Zn

Задача 6 Сплав железа и магния обработали избытком раствора серной кислоты . Масса выделившегося газа в 13,5 раза меньше массы сплава. Вычислите каких атомов в сплаве больше и во сколько раз? Напишем уравнения реакций

Пусть на 1 моль Fe приходится Х моль Mg всего

X=9,67 раз

Задачи для самостоятельного решения 1. Для получения нитрата натрия необходимое количество карбоната натрия растворили в 6,3% - азотной кислоте. Рассчитайте массовую долю соли в полученном растворе. Ответ: 8,2%. 2. Избыток кальция обработали некоторым количеством соляной кислоты с плотностью 1,05 г/мл. Определите массовую долю хлороводорода в исходной кислоте , если известно, что объем выделившегося водорода в 620 раз больше объема израсходованной кислоты. Ответ: 10,06%.

«Feci quod potui, faciant meliora potentes» «Я сделал, что мог; кто может, пусть сделает лучше» Цицерон