Презентация на тему: Хром (Cr)

ХРОМ Учитель химии МБОУ лицей №1 г. Волжский Волгоградская область Солдатова Татьяна Михайловна.



В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO4. Современное название — крокоит.







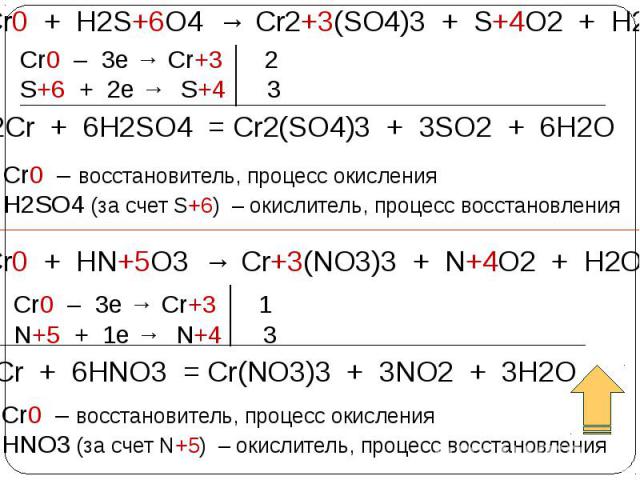
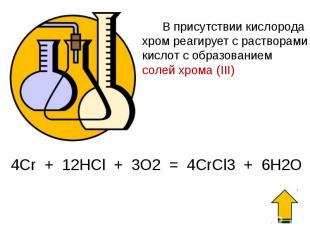
С помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса: С помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса: 1) восстановление шестивалентного хрома до трехвалентного с переходом его в раствор; 2) разряд ионов водорода с выделением газообразного водорода; 3) разряд ионов, содержащих шестивалентный хром с осаждением металлического хрома; Cr2O72− + 14Н+ + 12е− = 2Cr + 7H2O











Хром - постоянная составная часть растительных и животных организмов. В крови содержится от 0,012 до 0,0035 % хрома. Хром имеет большое значение в метаболизме углеводов и жиров, а также участвует в процессе синтеза инсулина. Важнейшая его биологическая роль состоит в регуляции углеводного обмена и уровня глюкозы в крови Элемент способствует нормальному формированию и росту детского организма. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови. Хром - постоянная составная часть растительных и животных организмов. В крови содержится от 0,012 до 0,0035 % хрома. Хром имеет большое значение в метаболизме углеводов и жиров, а также участвует в процессе синтеза инсулина. Важнейшая его биологическая роль состоит в регуляции углеводного обмена и уровня глюкозы в крови Элемент способствует нормальному формированию и росту детского организма. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.






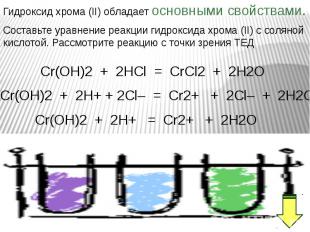






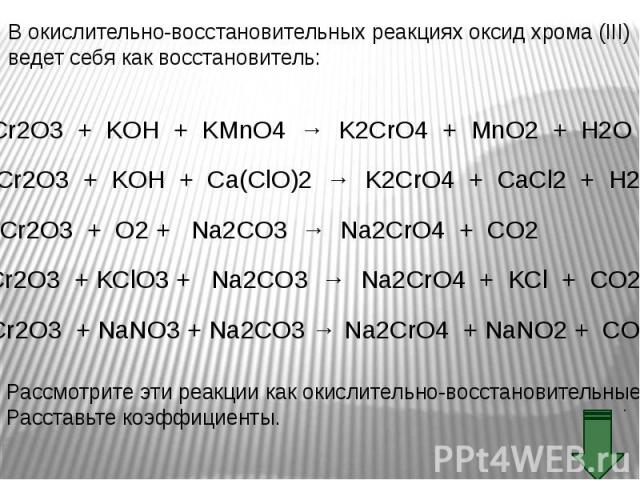
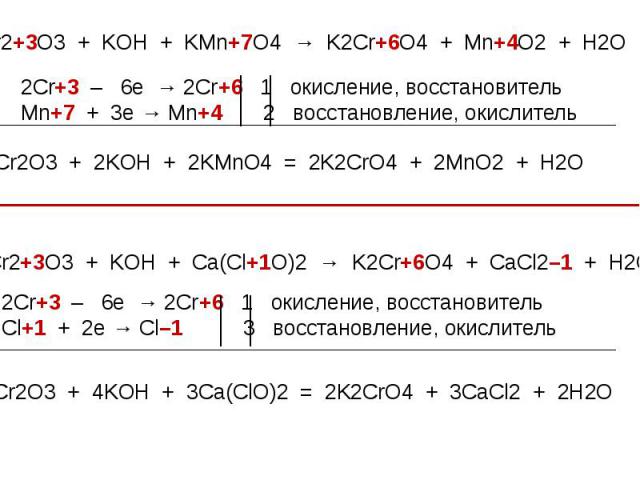
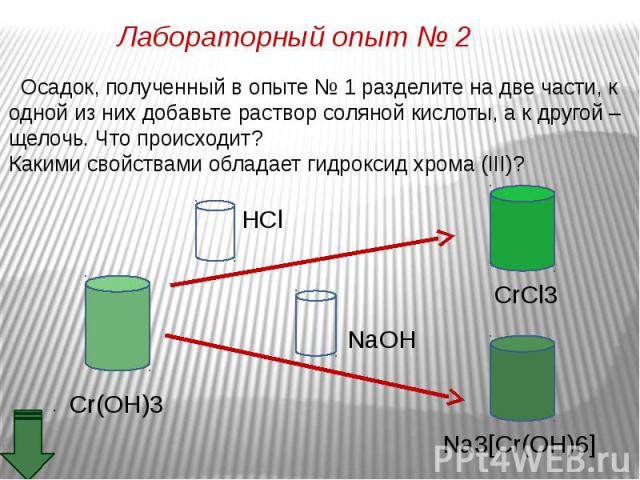
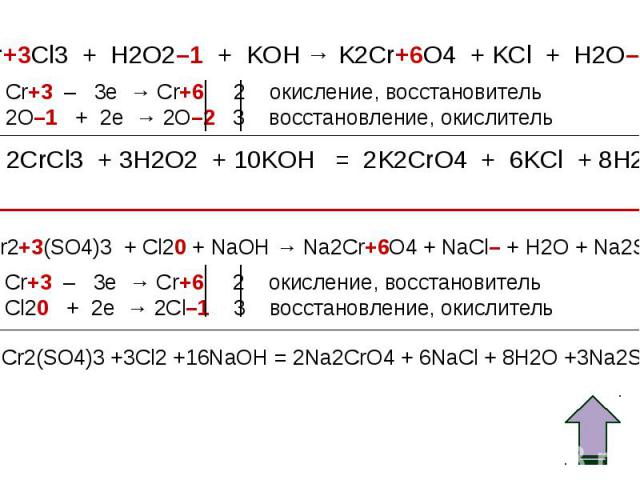
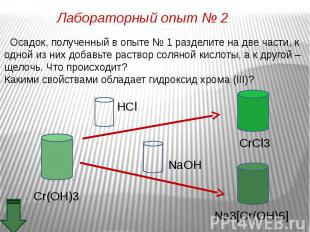
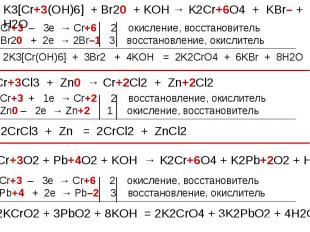
Оксид хрома (III) обладает амфотерными свойствами Оксид хрома (III) обладает амфотерными свойствами При взаимодействии с кислотами образуются соли хрома (III): Составьте уравнение реакции оксида хрома (III) с соляной кислотой. Рассмотрите реакцию с точки зрения ТЕД.



Оксид хрома (III) – катализатор Оксид хрома (III) – катализатор В присутствии оксида хрома (III) аммиак окисляется кислородом воздуха до монооксида азота, который в избытке кислорода окисляется до бурого диоксида азота.

Каталитическое окисление этанола Каталитическое окисление этанола Окисление этилового спирта кислородом воздуха происходит очень легко в присутствии оксида хрома (III) Реакция окисления спирта протекает с выделением энергии. Продукт реакции окисления спирта - уксусный альдегид.











Если поместить оксид хрома на фарфоровую пластинку и капнуть на него несколько капель ацетона,то через несколько секунд ацетон загорается. При этом оксид хрома (VI) восстанавливается до оксида хрома (III), а ацетон окисляется до углекислого газа и воды. Если поместить оксид хрома на фарфоровую пластинку и капнуть на него несколько капель ацетона,то через несколько секунд ацетон загорается. При этом оксид хрома (VI) восстанавливается до оксида хрома (III), а ацетон окисляется до углекислого газа и воды.

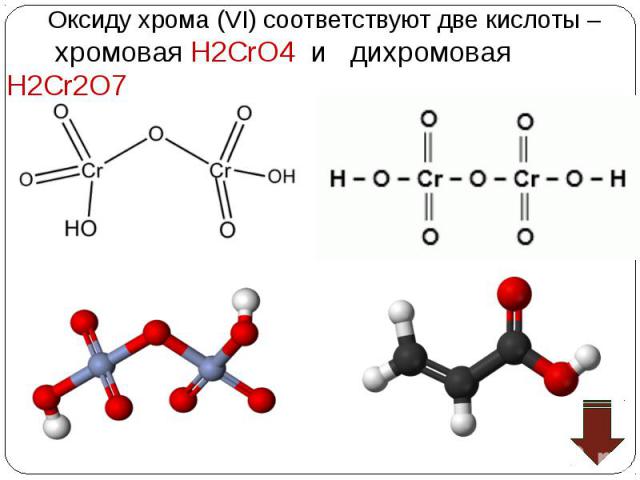
Хромовая кислота — кристаллическое вещество красного цвета; выделена в свободном состоянии при охлаждении насыщенных водных растворов CrO3; хромовая кислота — электролит средней силы. Изополихромовые кислоты существуют в водных растворах, окрашенных в красный цвет Хромовая кислота — кристаллическое вещество красного цвета; выделена в свободном состоянии при охлаждении насыщенных водных растворов CrO3; хромовая кислота — электролит средней силы. Изополихромовые кислоты существуют в водных растворах, окрашенных в красный цвет




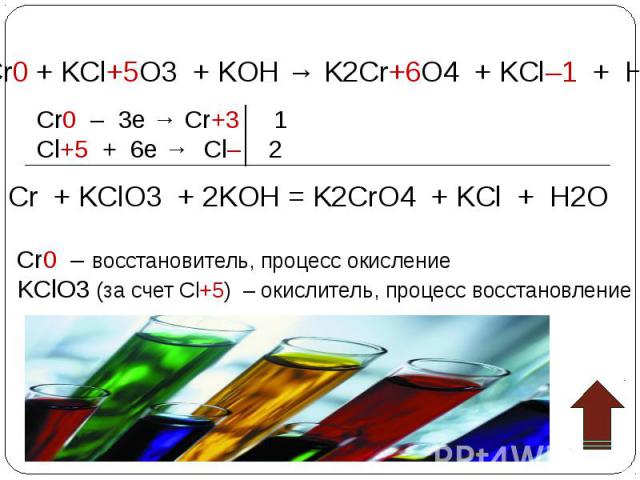
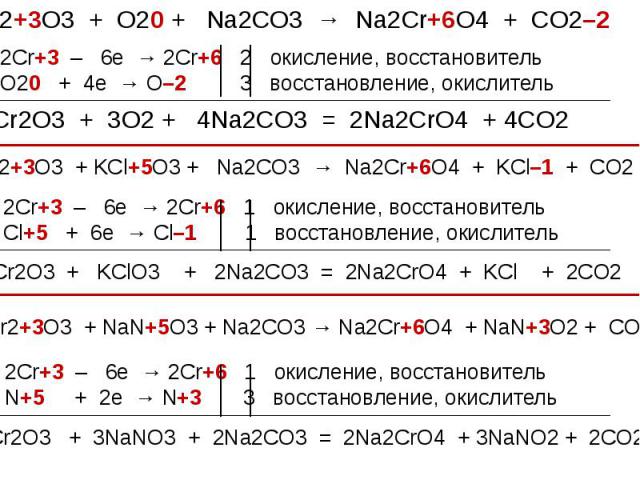
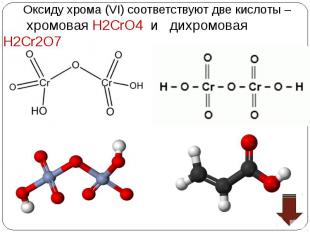
Взаимопревращение хроматов и дихроматов Взаимопревращение хроматов и дихроматов Оксиду хрома (VI) соответствуют две кислоты – хромовая Н2CrO4 и дихромовая Н2Cr2O7, Хромат калия K2CrO4 и дихромат калия K2Cr2O7 – соли этих кислот. Хроматы – желтого цвета, дихроматы – оранжевого. В кислой среде хромат-ион превращается в дихромат-ион. В присутствии щелочи дихроматы снова становятся хроматами. Хромат калия превращаем в дихромат, добавляя кислоту. Желтый раствор становится оранжевым. 2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O В стакан с дихроматом калия добавляем щелочь, оранжевый раствор становится желтым – дихроматы превращаются в хроматы. K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
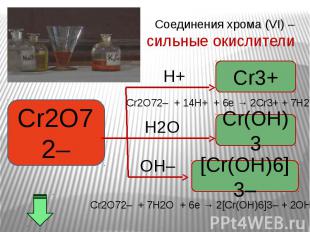

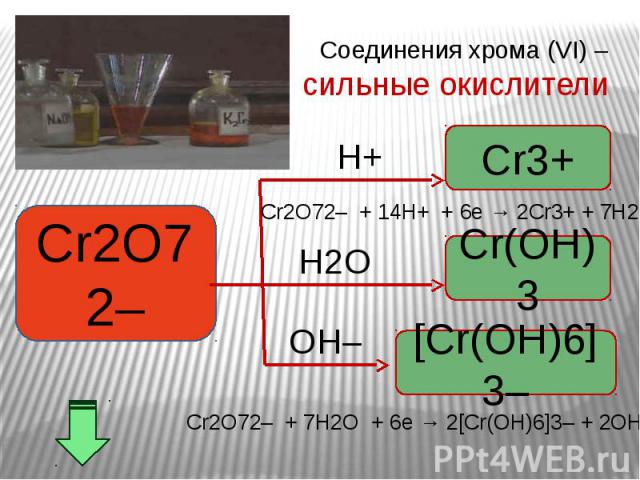
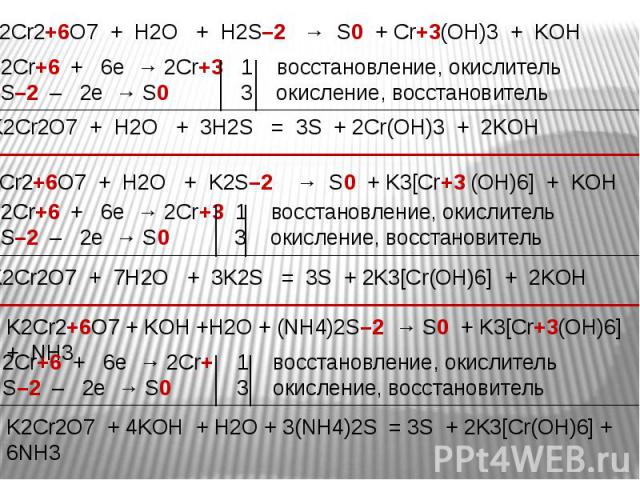
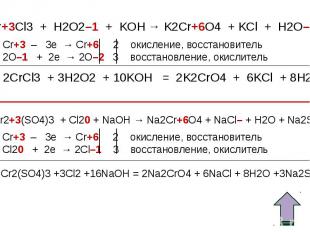
Окислительные свойства дихроматов Окислительные свойства дихроматов Дихроматы, например дихромат калия K2Cr2O7 – сильные окислители. Под действием восстановителей дихроматы в кислой среде переходят в соли хрома (III). Примером такой реакции может служить окисление сульфита натрия раствором дихромата калия в кислой среде. К раствору дихромата калия добавляем серную кислоту и раствор сульфита натрия. K2Cr2O7 +3Na2SO3+4H2SO4 =Cr2(SO4)3 + 3Na2SO4+ K2SO4 + 4H2O Оранжевая окраска, характерная для дихроматов, переходит в зеленую. Образовался раствор сульфата хрома (III) зеленого цвета. Соли хрома - ярко окрашены, именно поэтому элемент получил такое название: "хром", что в переводе с греческого означает "цвет, краска".







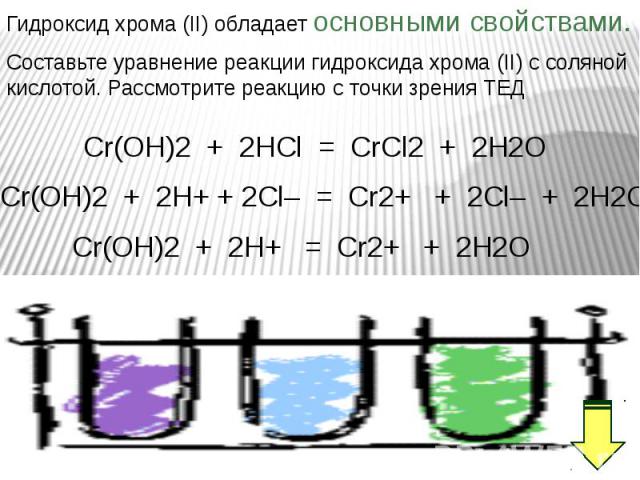
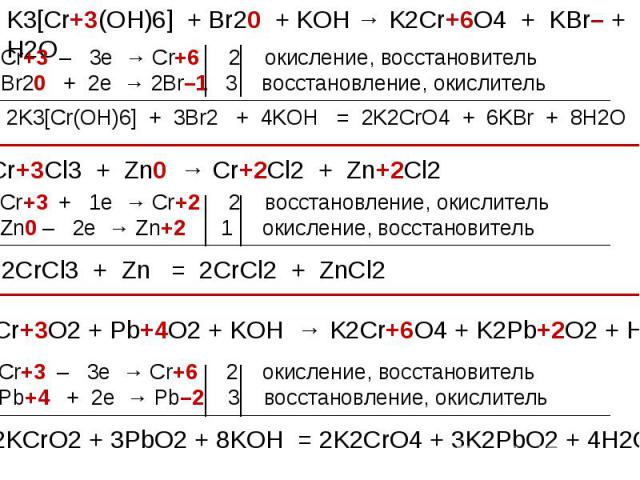
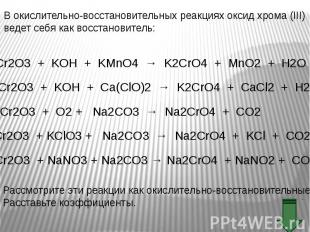
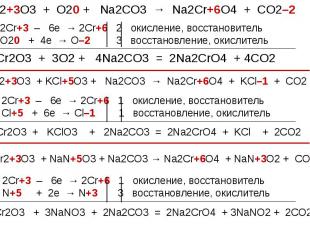
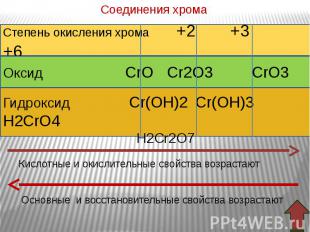
В ряду гидроксидов хрома различных степеней окисления В ряду гидроксидов хрома различных степеней окисления Cr(ОН)2 — Cr(ОН)3 — Н2CrО4 закономерно происходит ослабление основных свойств и усиление кислотных. Такое изменение свойств обусловлено увеличением степени окисления и уменьшением ионных радиусов хрома. В этом же ряду последовательно усиливаются окислительные свойства. Соединения Cr (II) — сильные восстановители, легко окисляются, превращаясь в соединения хрома (III). Соединения хрома(VI) — сильные окислители, легко восстанавливаются в соединения хрома (III). Соединения хрома (III), могут при взаимодействии с сильными восстановителями проявлять окислительные свойства, переходя в соединения хрома (II), а при взаимодействии с сильными окислителями проявлять восстановительные свойства, превращаясь в соединения хрома (VI).

Начала химии. Современный курс для поступающих в ВУЗы. – М.: 1Федеративная Книготорговая Компания. Начала химии. Современный курс для поступающих в ВУЗы. – М.: 1Федеративная Книготорговая Компания. Химия. Подготовка к ЕГЭ: учебно-методическое пособие / Под ред. В.Н. Доронькина. – Ростов н/Дону: Легион Химия. Пособие для поступающих в вузы /О.О. Максименко. – М. : Филол. о-во СЛОВО: Изд-во Эксмо Интернет-ресурсы (картинки, видеофрагменты: 1) Единая образовательная коллекция цифровых ресурсов. Химия. Неорганическая химия. Металлы побочных подгрупп. Хром. Видеопыты. http://school-collection.edu.ru/ 2) Образовательная коллекция Химия для всех XXI Химические опыты со взрывами и без