Презентация на тему: Хлор

Хлор Презентация по химии Ученицы 11 класса Каримовой Юлии Учитель химии Столяренко С.Ю. 5klass.net

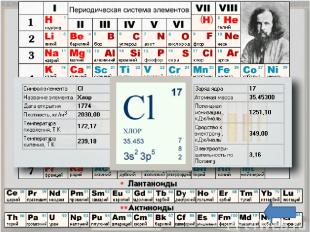
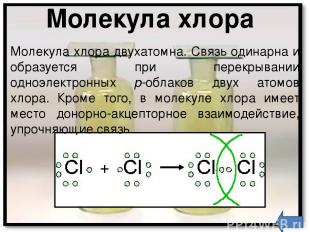
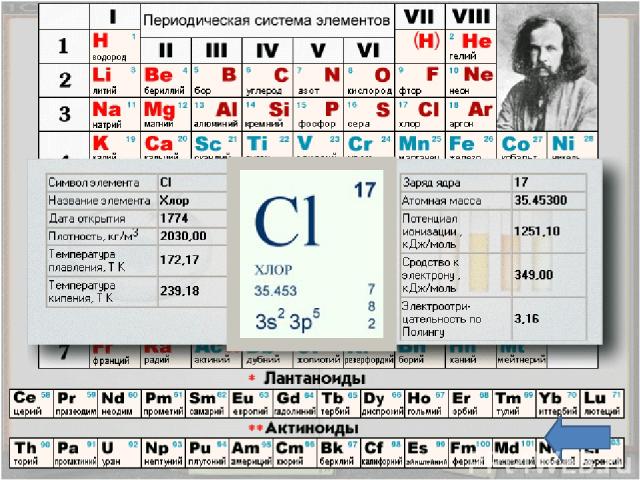
Положение в таблице Хлор - химический элемент седьмой группы, главной подгруппы, третьего периода периодической системы элементов Д. И. Менделеева, порядковый номер 17, относительная атомная масса 35,4527, относится к галогенам. Общее название элементов VIIA группы – галогены – происходит от греческих слов – "галс" – соль и "генес" – рождающий, т. е. "солероды". У галогенов наиболее ярко по сравнению с остальными элементами выражены свойства неметаллов. Говорят, галогены – типичные неметаллы.

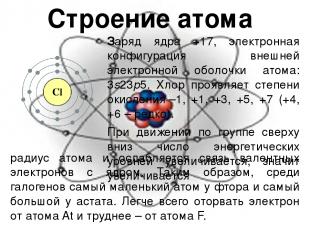
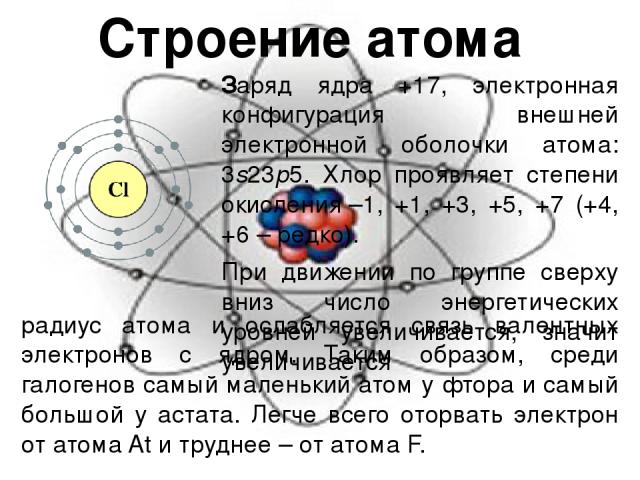
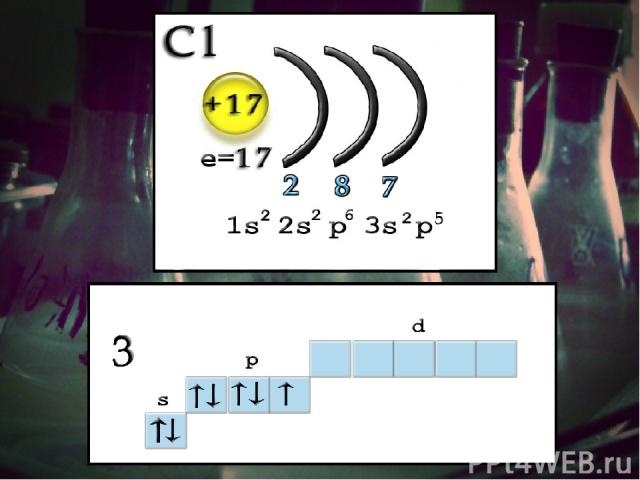
Строение атома Заряд ядра +17, электронная конфигурация внешней электронной оболочки атома: 3s23p5. Хлор проявляет степени окисления –1, +1, +3, +5, +7 (+4, +6 – редко). При движении по группе сверху вниз число энергетических уровней увеличивается, значит увеличивается радиус атома и ослабляется связь валентных электронов с ядром. Таким образом, среди галогенов самый маленький атом у фтора и самый большой у астата. Легче всего оторвать электрон от атома At и труднее – от атома F.
История открытия Первым из галогенов был открыт хлор (К. Шееле, 1774 год). Полученный желто-зеленый газ шведский ученый принял за сложное вещество. Лавуазье и Бертолле считали, что этот газ является оксидом неизвестного элемента "мурия". В 1807 году английский химик Гемфри Дэви получил тот же газ, что и Шееле. Три года пытался Дэви выделить из него "мурий", но безуспешно. Он пришел к выводу, что получил новый элемент и назвал его "хлорин" (от "хлорос" – желто-зеленый). Через пять лет Гей-Люсак дал газу название хлор. В жидком виде хлор был впервые получен в 1823 году М. Фарадеем.
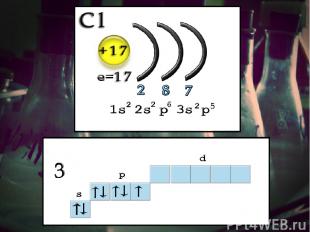

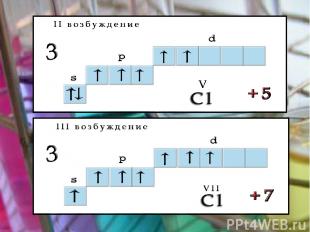
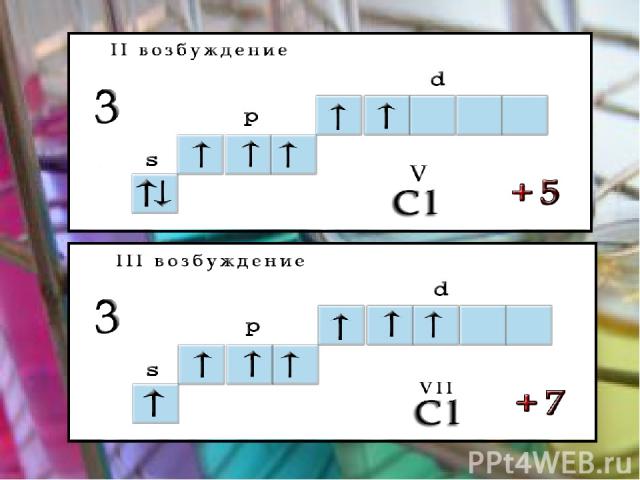
Возбуждения В невозбужденном состоянии галогены имеют валентность, равную 1, а в возбужденном (переход электронов на вакантные d-облака) увеличивается число неспаренных электронов до 7. Следовательно, валентность галогенов может быть 3; 5; 7 (исключение атом фтора).
Применение хлора Хлор применяют во многих отраслях промышленности, науки и бытовых нужд: Основным компонентом отбеливателей является хлорная вода В производстве поливинилхлорида, пластикатов, синтетического каучука, из которых изготавливают изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы.

Физические свойства Хлор – ядовитый газ желто-зеленого цвета с резким запахом. Это первое химическое оружие. Во время Первой мировой войны 1914–1918 гг. его применяли в качестве боевого отравляющего вещества. Хлор тяжелее воздуха в 2,5 раза, поэтому стелется по земле и в виде газового облака переносится ветром на значительные расстояния. Хлор вызывает раздражение дыхательных путей, а вдыхание большого его количества вызывает смерть от удушья. При содержании хлора в воздухе 0,9 мл/л смерть наступает в течение 5 минут.

Физические свойства

Минералы Каменная соль = поваренная соль = галит Карналлит Сильвин

Получение 2KMnO4+16HCl (конц.)= 2KCl + 2MnCl2 + 8H2O + 5Cl2

Хлор - один из самых активных неметаллов. При взаимодействии с металлами с переменной валентностью (Fe, Cr) в отличие от соляной кислоты заставляет их проявлять большую степень окисления: С Металлами 2Al + 3Cl2 = 2AlCl3 2K + Cl2 = 2 КCl 2 Fe + 3Cl2 = 2 FeCl3 Cu + Cl2 = CuCl2

Cu+Cl2=CuCl2 2Fe+3Cl2 = 2FeCl3

H2 + Cl2 = 2 HCl(на свету) С Неметаллами 2Cl2 + C = CCl4 3Cl2 + 2P (крист.) = 2PCl3 5 Cl2 + 2 P = 2PCl5

Образует соединения с другими галогенами: Cl2 + F2 = 2ClF Cl2 + 3F2 = 2ClF3, t = 200–400 °C Cl2 + 5F2 = 2ClF5 5Cl2 + 2Sb = 2SbCl5

Хлор растворяется вводе (в 1 объеме воды растворяется 2 объема хлора) с образованием "хлорной воды": Cl2 + H2O = HCl + HClO С Водой Со щелочами Cl2 + 2KOH(хол) = KCl + KClO(гипохлорит) + H2O Cl2 + 6KOH(гор) = 5KCl + KClO3(хлорат) + 3H2O

С Бескислородными Кислотами Cl2 + HBr = 2HCl + Br2 Cl2 + HI = 2HCl + I2 Cl2 + 2NaI = 2NaCl + I2 Cl2 + FeCl2 = 2FeCl3 С Солями

Хлор в органике Хлор является активным реагентом в органическом синтезе. Его атомы входят в состав молекул соединений, относящихся к различным классам органических веществ. CnH2n+2 + Cl2 (на свету) = CnH2n+1Cl + HCl [р. Семенова] CnH2n + Cl2 = CnH2nCl2 CnH2n-2 + Cl2 – в несколько стадий C6H6 + Cl2 (AlCl3) = C6H5Cl + HCl C6H6 + Cl2 (на свету) = гексахлоран Гомологи бензола + Cl2 (на свету) = замещение по радикальному механизму (Cl к альфа-H) 5. R-CH2-COOH + Cl2 (PCl5) = R-CHCl-COOH + HCl

Для обеззараживания воды — «хлорирования». В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений.

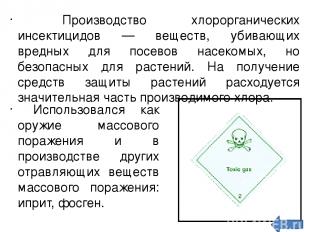
Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасных для растений. На получение средств защиты растений расходуется значительная часть производимого хлора. Использовался как оружие массового поражения и в производстве других отравляющих веществ массового поражения: иприт, фосген.




















![Хлор в органике Хлор является активным реагентом в органическом синтезе. Его атомы входят в состав молекул соединений, относящихся к различным классам органических веществ. CnH2n+2 + Cl2 (на свету) = CnH2n+1Cl + HCl [р. Семенова] CnH2n + Cl2 = CnH2n… Хлор в органике Хлор является активным реагентом в органическом синтезе. Его атомы входят в состав молекул соединений, относящихся к различным классам органических веществ. CnH2n+2 + Cl2 (на свету) = CnH2n+1Cl + HCl [р. Семенова] CnH2n + Cl2 = CnH2n…](https://fs3.ppt4web.ru/images/132073/184173/640/img19.jpg)