Презентация на тему: Химия элементов

![В водных растворах: В водных растворах: [Be(H2O)4]2+ [Al(H2O)6]3+ [Cr(H2O)6]3+ … В водных растворах: В водных растворах: [Be(H2O)4]2+ [Al(H2O)6]3+ [Cr(H2O)6]3+ …](https://fs1.ppt4web.ru/images/95606/160008/310/img1.jpg)
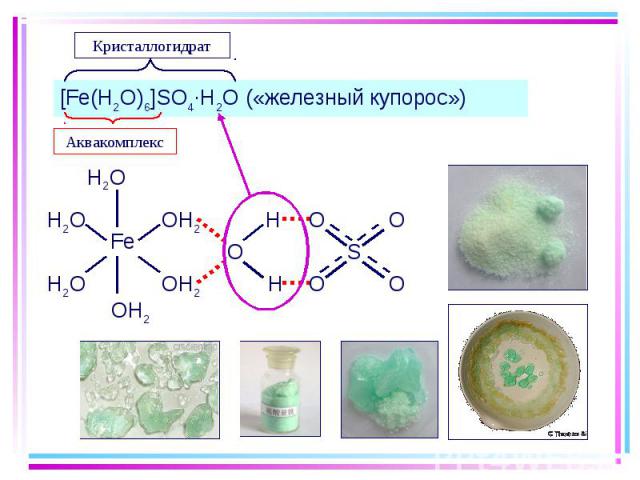
В водных растворах: В водных растворах: [Be(H2O)4]2+ [Al(H2O)6]3+ [Cr(H2O)6]3+ … Кристаллогидраты: [Be(H2O)4]SO4 [Al(H2O)6]Cl3 [K(H2O)6][Cr(H2O)6](SO4)2 [Cu(H2O)4]SO4·H2O [Ni(H2O)6]SO4·H2O
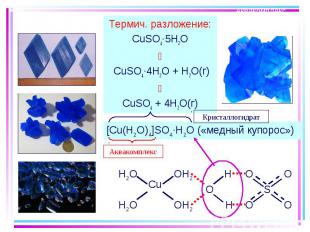
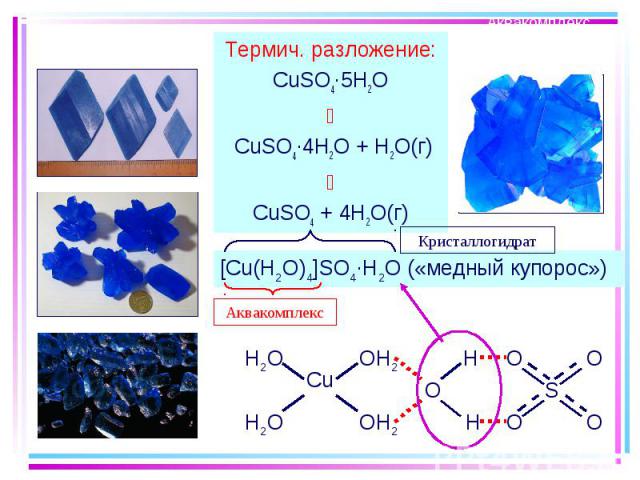
Термич. разложение: Термич. разложение: CuSO4·5H2O CuSO4·4H2O + H2O(г) CuSO4 + 4H2O(г)
![Получение: Получение: Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–; pH >> 7 Разрушен Получение: Получение: Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–; pH >> 7 Разрушен](https://fs1.ppt4web.ru/images/95606/160008/310/img4.jpg)
Получение: Получение: Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–; pH >> 7 Разрушение: [Zn(OH)4]2– (+H3O+) + CH3COOH; CO2; NH4+ (сл.к-ты, pH 7) Zn(OH)2(т) + H3O+ (сильн.к-ты, pH < 7) [Zn(H2O)4]2+ Образование гидроксокомплексов характерно для амфотерных элементов.
![Получение: Получение: AgCl(т) + 2NH3·H2O(изб.) = [Ag(NH3)2]+ +Cl– + 2H2O Разруше Получение: Получение: AgCl(т) + 2NH3·H2O(изб.) = [Ag(NH3)2]+ +Cl– + 2H2O Разруше](https://fs1.ppt4web.ru/images/95606/160008/310/img5.jpg)
Получение: Получение: AgCl(т) + 2NH3·H2O(изб.) = [Ag(NH3)2]+ +Cl– + 2H2O Разрушение: [Ag(NH3)2]+ + H3O+ NH4+ + … [Ag(NH3)2]+ + I– AgI(т) + … [Ag(NH3)2]+ + t° NH3(г) + …
![Получение: Получение: HgI2(т) + 2I–(изб.) = [HgI4]2– [Fe(H2O)6]3+ + 6NCS−=[Fe(NC Получение: Получение: HgI2(т) + 2I–(изб.) = [HgI4]2– [Fe(H2O)6]3+ + 6NCS−=[Fe(NC](https://fs1.ppt4web.ru/images/95606/160008/310/img6.jpg)
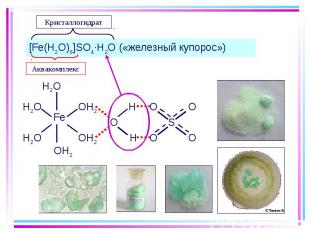
Получение: Получение: HgI2(т) + 2I–(изб.) = [HgI4]2– [Fe(H2O)6]3+ + 6NCS−=[Fe(NCS)6]3− + 6H2O Разрушение: [HgI4]2– + S2– = HgS(т) + 4I– [Fe(NCS)6]3− + 4F− = [FeF4]− + 6NCS−
![Получение: Получение: 4 NaH + B(OCH3)3 = Na[BH4] + 3CH3ONa (при 250 C) 4 LiH + A Получение: Получение: 4 NaH + B(OCH3)3 = Na[BH4] + 3CH3ONa (при 250 C) 4 LiH + A](https://fs1.ppt4web.ru/images/95606/160008/310/img7.jpg)
Получение: Получение: 4 NaH + B(OCH3)3 = Na[BH4] + 3CH3ONa (при 250 C) 4 LiH + AlCl3 = Li[AlH4] + 3LiCl 3 Li[BH4] + AlCl3 = Al[BH4]3 + 3LiCl Разрушение: Na[AlH4] + 4 H2O = NaOH + Al(OH)3 + 4 H2 (ОВР) 2 Na[BH4] + H2SO4 = Na2SO4 + B2H6 + 2 H2 (ОВР)
![Получение: Получение: KI + I2 = K[I(I)2]; CsCl + IBr = Cs[I(Br)(Cl)] Разрушение: Получение: Получение: KI + I2 = K[I(I)2]; CsCl + IBr = Cs[I(Br)(Cl)] Разрушение:](https://fs1.ppt4web.ru/images/95606/160008/310/img8.jpg)
Получение: Получение: KI + I2 = K[I(I)2]; CsCl + IBr = Cs[I(Br)(Cl)] Разрушение: K[I(I)2] + t° = KI + I2(г) Cs[I(Br)(Cl)] + t° = CsCl + IBr(г)
 (ниже 50 С) тетракарбонилник Получение: Получение: Ni(т) + 4CO(г) = [Ni(CO)4](ж) (ниже 50 С) тетракарбонилник](https://fs1.ppt4web.ru/images/95606/160008/310/img9.jpg)
Получение: Получение: Ni(т) + 4CO(г) = [Ni(CO)4](ж) (ниже 50 С) тетракарбонилникель(0) Разрушение: [Ni(CO)4](ж) + t° = Ni(т) + 4 CO(г) (выше 200 С) [Ni(CO)4] + H2SO4(разб.) = NiSO4 + 4 CO + H2

![* 27Co0 [Ar]3d74s2 || 36Kr * 27Co0 [Ar]3d74s2 || 36Kr * 18 – 9 = 9e –; * х = 9/2 * 27Co0 [Ar]3d74s2 || 36Kr * 27Co0 [Ar]3d74s2 || 36Kr * 18 – 9 = 9e –; * х = 9/2](https://fs1.ppt4web.ru/images/95606/160008/310/img11.jpg)
* 27Co0 [Ar]3d74s2 || 36Kr * 27Co0 [Ar]3d74s2 || 36Kr * 18 – 9 = 9e –; * х = 9/2 = 4,5 (?) * радикал [·Co(CO)4] * тетракарбонилкобальт (неуст.) * димер [Co2(CO)8] (уст.) октакарбонилдикобальт
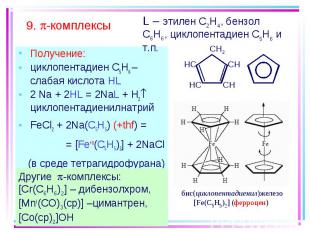
Получение: Получение: циклопентадиен С5H6 – слабая кислота HL 2 Na + 2HL = 2NaL + H2 циклопентадиенилнатрий FeCl2 + 2Na(C5H5) (+thf) = = [Fe+II(C5H5)2] + 2NaCl (в среде тетрагидрофурана)
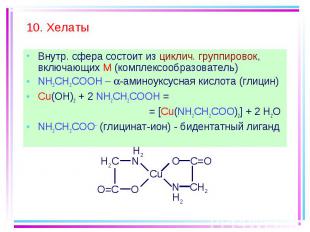
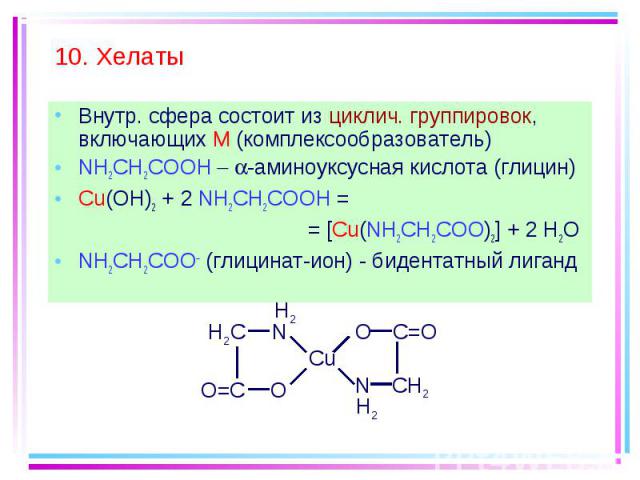
Внутр. сфера состоит из циклич. группировок, включающих M (комплексообразователь) Внутр. сфера состоит из циклич. группировок, включающих M (комплексообразователь) NH2CH2COOH -аминоуксусная кислота (глицин) Cu(OH)2 + 2 NH2CH2COOH = = [Cu(NH2CH2COO)2] + 2 H2O NH2CH2COO (глицинат-ион) - бидентатный лиганд
 + 2NH4+ + 2H2 Ni2+ + 2 NH3·H2O + 2H2L = Ni2+ + 2 NH3·H2O + 2H2L = = [Ni(HL)2](т) + 2NH4+ + 2H2](https://fs1.ppt4web.ru/images/95606/160008/310/img14.jpg)
Ni2+ + 2 NH3·H2O + 2H2L = Ni2+ + 2 NH3·H2O + 2H2L = = [Ni(HL)2](т) + 2NH4+ + 2H2O бис(диметилглиоксимато)никель(II)

Реакция обмена лигандов Реакция обмена лигандов А) в водном растворе ( обр, принцип Ле Шателье): [Сu(H2O)4]2+ + 4NH3·H2O = [Cu(NH3)4]2+ + 8H2O (обр. прод.) > (обр. исх.реаг.) Б) в неводном растворителе: [Al(H2O)6]3+ + NH3·H2O [Al(H2O)6]3+(s) + 6NH3(ж) = [Al(NH3)6]3+(s) + 6H2O(s) В) без растворителя: [Ni(H2O)6]Cl2(т) + 6NH3(г) = [Ni(NH3)6]Cl2(т) +6H2O(г) Г) внутримол. обмен лигандов в тв. фазе: 2[Co(H2O)6]Cl2(т) + t° = Co[CoCl4](т) + 12H2O розовый синий

Д) ОВР + реакции обмена лигандов Д) ОВР + реакции обмена лигандов +Ок.+ L [СoII(H2O)6]2+ [СoIIIL6]3+ Ок.: H2O2, KNO2 … L – NH3, NO2– … Примеры: 2CoIICl2 + 12NH3 + H2O2 = 2[CoIII(NH3)6](OH)Cl2 CoIICl2 + 7KNO2 + 2CH3COOH = = K3[CoIII(NO2)6] + NO + 2KCl + 2CH3COOK + H2O + Вс [NiII(CN)4]2– [Ni0(CN)4]4–

AgBr(т) Ag+ + Br – ; ПРAgBr = 7,7·10–13 AgBr(т) Ag+ + Br – ; ПРAgBr = 7,7·10–13 Ag+ + 2 SO3S2– [Ag(SO3S)2]3– ; обр = 4·1013 AgBr(т) + 2 SO3S2– [Ag(SO3S)2]3– + Br –; Kc = ?
![[Co(NH3)6]3+ + 6 CN– [Co(CN)6]3– + 6 NH3 ; [Co(NH3)6]3+ + 6 CN– [Co(CN)6]3– + 6 [Co(NH3)6]3+ + 6 CN– [Co(CN)6]3– + 6 NH3 ; [Co(NH3)6]3+ + 6 CN– [Co(CN)6]3– + 6](https://fs1.ppt4web.ru/images/95606/160008/310/img18.jpg)
[Co(NH3)6]3+ + 6 CN– [Co(CN)6]3– + 6 NH3 ; [Co(NH3)6]3+ + 6 CN– [Co(CN)6]3– + 6 NH3 ; Kc = ? Co3+ + 6 NH3 [Co(NH3)6]3+ ; обр(1) = 1,6·1035 Co3+ + 6 CN– [Co(CN)6]3– ; обр(2) = 1,0·1064
![[Cu(NH3)4]2+ + 4 H3O+ [Cu(H2O)4]2+ + 4 NH4+ ; [Cu(NH3)4]2+ + 4 H3O+ [Cu(H2O)4]2+ [Cu(NH3)4]2+ + 4 H3O+ [Cu(H2O)4]2+ + 4 NH4+ ; [Cu(NH3)4]2+ + 4 H3O+ [Cu(H2O)4]2+](https://fs1.ppt4web.ru/images/95606/160008/310/img19.jpg)
[Cu(NH3)4]2+ + 4 H3O+ [Cu(H2O)4]2+ + 4 NH4+ ; [Cu(NH3)4]2+ + 4 H3O+ [Cu(H2O)4]2+ + 4 NH4+ ; Kc = ? Cu2+ + 4 NH3 [Cu(NH3)4]2+ ; обр = 7,9·1012 NH4+ + 2H2O NH3·H2O + H3O+ ; Kк = 5,75·10–10
![CuCN(т) + H2O + HCN [Cu(CN)2]– + H3O+ CuCN(т) + H2O + HCN [Cu(CN)2]– + H3O+ Kc = CuCN(т) + H2O + HCN [Cu(CN)2]– + H3O+ CuCN(т) + H2O + HCN [Cu(CN)2]– + H3O+ Kc =](https://fs1.ppt4web.ru/images/95606/160008/310/img20.jpg)
CuCN(т) + H2O + HCN [Cu(CN)2]– + H3O+ CuCN(т) + H2O + HCN [Cu(CN)2]– + H3O+ Kc = ? Cu+ + 2CN– [Cu(CN)2]– ; обр = 1,0·1024 HCN + H2O CN– + H3O+ ; Kк = = 4,93·10–10 CuCN(т) Cu+ + CN– ; ПРCuCN = 3,2·10–20


![В водных растворах: В водных растворах: [Be(H2O)4]2+ [Al(H2O)6]3+ [Cr(H2O)6]3+ … Кристаллогидраты: [Be(H2O)4]SO4 [Al(H2O)6]Cl3 [K(H2O)6][Cr(H2O)6](SO4)2 [Cu(H2O)4]SO4·H2O [Ni(H2O)6]SO4·H2O В водных растворах: В водных растворах: [Be(H2O)4]2+ [Al(H2O)6]3+ [Cr(H2O)6]3+ … Кристаллогидраты: [Be(H2O)4]SO4 [Al(H2O)6]Cl3 [K(H2O)6][Cr(H2O)6](SO4)2 [Cu(H2O)4]SO4·H2O [Ni(H2O)6]SO4·H2O](https://fs1.ppt4web.ru/images/95606/160008/640/img1.jpg)
![Получение: Получение: Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–; pH >> 7 Разрушение: [Zn(OH)4]2– (+H3O+) + CH3COOH; CO2; NH4+ (сл.к-ты, pH 7) Zn(OH)2(т) + H3O+ (сильн.к-ты, pH < 7) [Zn(H2O)4]2+ Образование гидроксокомплексов характерно для амфотер… Получение: Получение: Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–; pH >> 7 Разрушение: [Zn(OH)4]2– (+H3O+) + CH3COOH; CO2; NH4+ (сл.к-ты, pH 7) Zn(OH)2(т) + H3O+ (сильн.к-ты, pH < 7) [Zn(H2O)4]2+ Образование гидроксокомплексов характерно для амфотер…](https://fs1.ppt4web.ru/images/95606/160008/640/img4.jpg)
![Получение: Получение: AgCl(т) + 2NH3·H2O(изб.) = [Ag(NH3)2]+ +Cl– + 2H2O Разрушение: [Ag(NH3)2]+ + H3O+ NH4+ + … [Ag(NH3)2]+ + I– AgI(т) + … [Ag(NH3)2]+ + t° NH3(г) + … Получение: Получение: AgCl(т) + 2NH3·H2O(изб.) = [Ag(NH3)2]+ +Cl– + 2H2O Разрушение: [Ag(NH3)2]+ + H3O+ NH4+ + … [Ag(NH3)2]+ + I– AgI(т) + … [Ag(NH3)2]+ + t° NH3(г) + …](https://fs1.ppt4web.ru/images/95606/160008/640/img5.jpg)
![Получение: Получение: HgI2(т) + 2I–(изб.) = [HgI4]2– [Fe(H2O)6]3+ + 6NCS−=[Fe(NCS)6]3− + 6H2O Разрушение: [HgI4]2– + S2– = HgS(т) + 4I– [Fe(NCS)6]3− + 4F− = [FeF4]− + 6NCS− Получение: Получение: HgI2(т) + 2I–(изб.) = [HgI4]2– [Fe(H2O)6]3+ + 6NCS−=[Fe(NCS)6]3− + 6H2O Разрушение: [HgI4]2– + S2– = HgS(т) + 4I– [Fe(NCS)6]3− + 4F− = [FeF4]− + 6NCS−](https://fs1.ppt4web.ru/images/95606/160008/640/img6.jpg)
![Получение: Получение: 4 NaH + B(OCH3)3 = Na[BH4] + 3CH3ONa (при 250 C) 4 LiH + AlCl3 = Li[AlH4] + 3LiCl 3 Li[BH4] + AlCl3 = Al[BH4]3 + 3LiCl Разрушение: Na[AlH4] + 4 H2O = NaOH + Al(OH)3 + 4 H2 (ОВР) 2 Na[BH4] + H2SO4 = Na2SO4 + B2H6 + 2 H2 (ОВР) Получение: Получение: 4 NaH + B(OCH3)3 = Na[BH4] + 3CH3ONa (при 250 C) 4 LiH + AlCl3 = Li[AlH4] + 3LiCl 3 Li[BH4] + AlCl3 = Al[BH4]3 + 3LiCl Разрушение: Na[AlH4] + 4 H2O = NaOH + Al(OH)3 + 4 H2 (ОВР) 2 Na[BH4] + H2SO4 = Na2SO4 + B2H6 + 2 H2 (ОВР)](https://fs1.ppt4web.ru/images/95606/160008/640/img7.jpg)
![Получение: Получение: KI + I2 = K[I(I)2]; CsCl + IBr = Cs[I(Br)(Cl)] Разрушение: K[I(I)2] + t° = KI + I2(г) Cs[I(Br)(Cl)] + t° = CsCl + IBr(г) Получение: Получение: KI + I2 = K[I(I)2]; CsCl + IBr = Cs[I(Br)(Cl)] Разрушение: K[I(I)2] + t° = KI + I2(г) Cs[I(Br)(Cl)] + t° = CsCl + IBr(г)](https://fs1.ppt4web.ru/images/95606/160008/640/img8.jpg)
 (ниже 50 С) тетракарбонилникель(0) Разрушение: [Ni(CO)4](ж) + t° = Ni(т) + 4 CO(г) (выше 200 С) [Ni(CO)4] + H2SO4(разб.) = NiSO4 + 4 CO + H2 Получение: Получение: Ni(т) + 4CO(г) = [Ni(CO)4](ж) (ниже 50 С) тетракарбонилникель(0) Разрушение: [Ni(CO)4](ж) + t° = Ni(т) + 4 CO(г) (выше 200 С) [Ni(CO)4] + H2SO4(разб.) = NiSO4 + 4 CO + H2](https://fs1.ppt4web.ru/images/95606/160008/640/img9.jpg)

![* 27Co0 [Ar]3d74s2 || 36Kr * 27Co0 [Ar]3d74s2 || 36Kr * 18 – 9 = 9e –; * х = 9/2 = 4,5 (?) * радикал [·Co(CO)4] * тетракарбонилкобальт (неуст.) * димер [Co2(CO)8] (уст.) октакарбонилдикобальт * 27Co0 [Ar]3d74s2 || 36Kr * 27Co0 [Ar]3d74s2 || 36Kr * 18 – 9 = 9e –; * х = 9/2 = 4,5 (?) * радикал [·Co(CO)4] * тетракарбонилкобальт (неуст.) * димер [Co2(CO)8] (уст.) октакарбонилдикобальт](https://fs1.ppt4web.ru/images/95606/160008/640/img11.jpg)
![Получение: Получение: циклопентадиен С5H6 – слабая кислота HL 2 Na + 2HL = 2NaL + H2 циклопентадиенилнатрий FeCl2 + 2Na(C5H5) (+thf) = = [Fe+II(C5H5)2] + 2NaCl (в среде тетрагидрофурана) Получение: Получение: циклопентадиен С5H6 – слабая кислота HL 2 Na + 2HL = 2NaL + H2 циклопентадиенилнатрий FeCl2 + 2Na(C5H5) (+thf) = = [Fe+II(C5H5)2] + 2NaCl (в среде тетрагидрофурана)](https://fs1.ppt4web.ru/images/95606/160008/640/img12.jpg)
 + 2NH4+ + 2H2O бис(диметилглиоксимато)никель(II) Ni2+ + 2 NH3·H2O + 2H2L = Ni2+ + 2 NH3·H2O + 2H2L = = [Ni(HL)2](т) + 2NH4+ + 2H2O бис(диметилглиоксимато)никель(II)](https://fs1.ppt4web.ru/images/95606/160008/640/img14.jpg)
![Реакция обмена лигандов Реакция обмена лигандов А) в водном растворе ( обр, принцип Ле Шателье): [Сu(H2O)4]2+ + 4NH3·H2O = [Cu(NH3)4]2+ + 8H2O (обр. прод.) > (обр. исх.реаг.) Б) в неводном растворителе: [Al(H2O)6]3+ + NH3·H2O [Al(H2O)6]3+(s) + 6N… Реакция обмена лигандов Реакция обмена лигандов А) в водном растворе ( обр, принцип Ле Шателье): [Сu(H2O)4]2+ + 4NH3·H2O = [Cu(NH3)4]2+ + 8H2O (обр. прод.) > (обр. исх.реаг.) Б) в неводном растворителе: [Al(H2O)6]3+ + NH3·H2O [Al(H2O)6]3+(s) + 6N…](https://fs1.ppt4web.ru/images/95606/160008/640/img15.jpg)
![Д) ОВР + реакции обмена лигандов Д) ОВР + реакции обмена лигандов +Ок.+ L [СoII(H2O)6]2+ [СoIIIL6]3+ Ок.: H2O2, KNO2 … L – NH3, NO2– … Примеры: 2CoIICl2 + 12NH3 + H2O2 = 2[CoIII(NH3)6](OH)Cl2 CoIICl2 + 7KNO2 + 2CH3COOH = = K3[CoIII(NO2)6] + NO + 2KC… Д) ОВР + реакции обмена лигандов Д) ОВР + реакции обмена лигандов +Ок.+ L [СoII(H2O)6]2+ [СoIIIL6]3+ Ок.: H2O2, KNO2 … L – NH3, NO2– … Примеры: 2CoIICl2 + 12NH3 + H2O2 = 2[CoIII(NH3)6](OH)Cl2 CoIICl2 + 7KNO2 + 2CH3COOH = = K3[CoIII(NO2)6] + NO + 2KC…](https://fs1.ppt4web.ru/images/95606/160008/640/img16.jpg)
![AgBr(т) Ag+ + Br – ; ПРAgBr = 7,7·10–13 AgBr(т) Ag+ + Br – ; ПРAgBr = 7,7·10–13 Ag+ + 2 SO3S2– [Ag(SO3S)2]3– ; обр = 4·1013 AgBr(т) + 2 SO3S2– [Ag(SO3S)2]3– + Br –; Kc = ? AgBr(т) Ag+ + Br – ; ПРAgBr = 7,7·10–13 AgBr(т) Ag+ + Br – ; ПРAgBr = 7,7·10–13 Ag+ + 2 SO3S2– [Ag(SO3S)2]3– ; обр = 4·1013 AgBr(т) + 2 SO3S2– [Ag(SO3S)2]3– + Br –; Kc = ?](https://fs1.ppt4web.ru/images/95606/160008/640/img17.jpg)
![[Co(NH3)6]3+ + 6 CN– [Co(CN)6]3– + 6 NH3 ; [Co(NH3)6]3+ + 6 CN– [Co(CN)6]3– + 6 NH3 ; Kc = ? Co3+ + 6 NH3 [Co(NH3)6]3+ ; обр(1) = 1,6·1035 Co3+ + 6 CN– [Co(CN)6]3– ; обр(2) = 1,0·1064 [Co(NH3)6]3+ + 6 CN– [Co(CN)6]3– + 6 NH3 ; [Co(NH3)6]3+ + 6 CN– [Co(CN)6]3– + 6 NH3 ; Kc = ? Co3+ + 6 NH3 [Co(NH3)6]3+ ; обр(1) = 1,6·1035 Co3+ + 6 CN– [Co(CN)6]3– ; обр(2) = 1,0·1064](https://fs1.ppt4web.ru/images/95606/160008/640/img18.jpg)
![[Cu(NH3)4]2+ + 4 H3O+ [Cu(H2O)4]2+ + 4 NH4+ ; [Cu(NH3)4]2+ + 4 H3O+ [Cu(H2O)4]2+ + 4 NH4+ ; Kc = ? Cu2+ + 4 NH3 [Cu(NH3)4]2+ ; обр = 7,9·1012 NH4+ + 2H2O NH3·H2O + H3O+ ; Kк = 5,75·10–10 [Cu(NH3)4]2+ + 4 H3O+ [Cu(H2O)4]2+ + 4 NH4+ ; [Cu(NH3)4]2+ + 4 H3O+ [Cu(H2O)4]2+ + 4 NH4+ ; Kc = ? Cu2+ + 4 NH3 [Cu(NH3)4]2+ ; обр = 7,9·1012 NH4+ + 2H2O NH3·H2O + H3O+ ; Kк = 5,75·10–10](https://fs1.ppt4web.ru/images/95606/160008/640/img19.jpg)
![CuCN(т) + H2O + HCN [Cu(CN)2]– + H3O+ CuCN(т) + H2O + HCN [Cu(CN)2]– + H3O+ Kc = ? Cu+ + 2CN– [Cu(CN)2]– ; обр = 1,0·1024 HCN + H2O CN– + H3O+ ; Kк = = 4,93·10–10 CuCN(т) Cu+ + CN– ; ПРCuCN = 3,2·10–20 CuCN(т) + H2O + HCN [Cu(CN)2]– + H3O+ CuCN(т) + H2O + HCN [Cu(CN)2]– + H3O+ Kc = ? Cu+ + 2CN– [Cu(CN)2]– ; обр = 1,0·1024 HCN + H2O CN– + H3O+ ; Kк = = 4,93·10–10 CuCN(т) Cu+ + CN– ; ПРCuCN = 3,2·10–20](https://fs1.ppt4web.ru/images/95606/160008/640/img20.jpg)