Презентация на тему: Химические свойства карбоновых кислот

МОУ Тормосиновская СОШ Химические свойства карбоновых кислот Урок химии в 10 классе Учитель: Киреева Марина Николаевна

Разминка Номенклатура.Изомерия.Химические свойства КК, общие с неорганическими кислотами.

Проверь себя!

Цель урока: изучить химические свойства предельных одноосновных карбоновых кислот

Проблема Некоторые лекарственные препараты нельзя запивать целым рядом напитков, в том числе кислые фрукты и соки, маринады, блюда с уксусом нельзя употреблять в пищу наряду с антибиотиками пенициллинового ряда и эритромицином. Как вы думаете, чем вызван данный запрет?
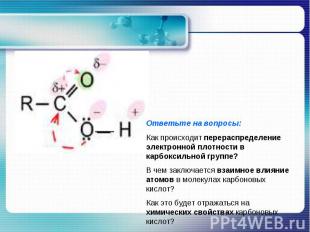
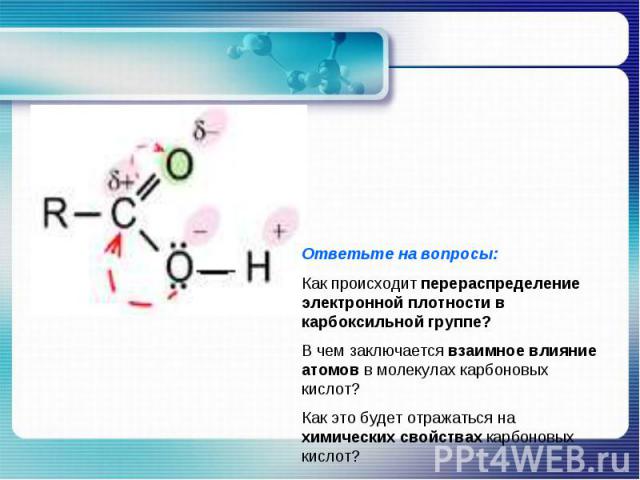
Ответьте на вопросы:Как происходит перераспределение электронной плотности в карбоксильной группе?В чем заключается взаимное влияние атомов в молекулах карбоновых кислот? Как это будет отражаться на химических свойствах карбоновых кислот?

Реакции с разрывом связи О - Н2. Взаимодействие с активными металлами.3. Взаимодействие с основаниями – реакция нейтрализации.4. Взаимодействие с основными оксидами.5. Взаимодействие с солями более слабых кислот.

Реакции с разрывом связи С - ОРеакция этерификации – образование сложного эфира при взаимодействии со спиртами. O H+ ׀׀CH3COOH + C2H5OH ↔ CH3 — C — O — C2H5 + H2O
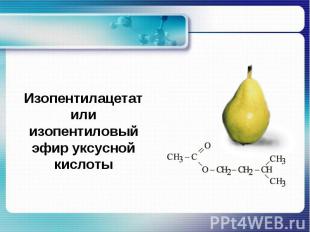
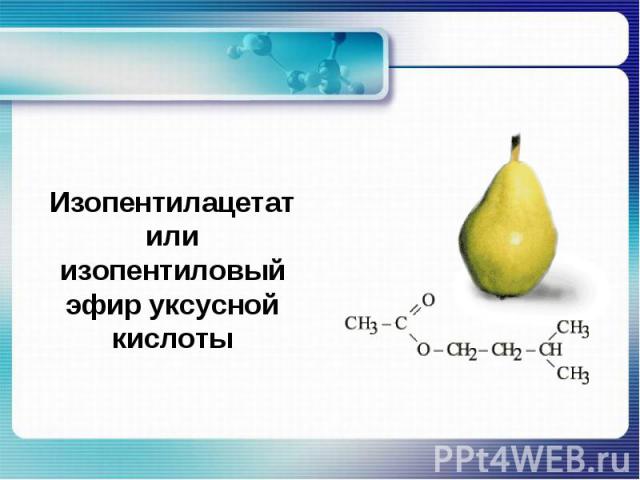
Изопентилацетат или изопентиловый эфир уксусной кислоты


2. Образование галогенангидридов при взаимодействии с галогенидами фосфора или тионилхлоридом SOCl2RCOOH + РСl 5 → RCOCl + РОСl3 + HCl хлорангидридRCOOH + SOCl2 → RCOCl + HCl + SO2 тионилхлорид

3. Межмолекулярная дегидратация карбоновых кислот с образованием ангидридов.2R-CO-OH + Р2О5 → (R-CO-)2O + 2Н2О.
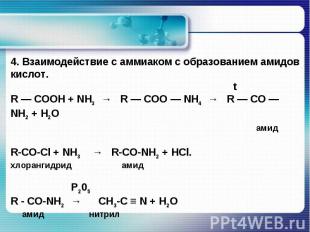
4. Взаимодействие с аммиаком с образованием амидов кислот. tR — COOH + NH3 → R — COO — NH4 → R — CO — NH2 + H2O амидR-СО-Сl + NН3 → R-СО-NН2 + HCl.хлорангидрид амид Р205R - CO-NH2 → CH3-C ≡ N + Н2О амид нитрил

Реакции с разрывом связи С – Н ( у α – С – атома) + Cl2 P кр + Cl2 P кр + Cl2 P кр CH3COOH → ClCH2COOH → Cl2 CHCOOH → Сl3COOHуксусная - HCl монохлоруксусная - HCl дихлоруксусная - HCl трихлоруксуснаякислота кислота кислота кислота
![Окислительно – восстановительные реакции 2[Н] СН3СООН → СН3СНО + Н2О 4[Н]СН3СОО Окислительно – восстановительные реакции 2[Н] СН3СООН → СН3СНО + Н2О 4[Н]СН3СОО](https://fs1.ppt4web.ru/images/9703/89170/310/img14.jpg)
Окислительно – восстановительные реакции 2[Н] СН3СООН → СН3СНО + Н2О 4[Н]СН3СООН → СН3СН2ОН + Н2О 6[Н]СН3СООН → С2Н6 + 2Н20Карбоновые кислоты при действии восстановителей в присутствии катализаторов способны превращаться в альдегиды, спирты и даже углеводороды

В атмосфере кислорода карбоновые кислоты окисляются до CO2 и H2O:R — COOH + O2 = CO2 + H2O

Закрепление Cu, t Cu (OH)2 C2H6 → C2H5I → C2H5OH → CH3COH → CH3COOH → CH3C — NH2 ׀׀ O

Домашнее задание:1 ВАРИАНТ ЗАДАНИЯ: § 20, опорный КОНСПЕКТ, 2 ВАРИАНТ ЗАДАНИЯ: § 20, опорный КОНСПЕКТ, цепочка превращенийТВОРЧЕСКОЕ ЗАДАНИЕ: ПРЕЗЕНТАЦИЯ О ПРИМЕНЕНИИ ОРГАНИЧЕСКИХ КИСЛОТ (ПО ЖЕЛАНИЮ)

Продолжи фразу. сегодня я узнал…было интересно…было трудно…я понял, что…теперь я могу…я почувствовал, что…я приобрел…я научился…у меня получилось …меня удивило…урок дал мне для жизни…мне захотелось…
«Острова»

Спасибо за работу!













![Окислительно – восстановительные реакции 2[Н] СН3СООН → СН3СНО + Н2О 4[Н]СН3СООН → СН3СН2ОН + Н2О 6[Н]СН3СООН → С2Н6 + 2Н20Карбоновые кислоты при действии восстановителей в присутствии катализаторов способны превращаться в альдегиды, спирты и даже … Окислительно – восстановительные реакции 2[Н] СН3СООН → СН3СНО + Н2О 4[Н]СН3СООН → СН3СН2ОН + Н2О 6[Н]СН3СООН → С2Н6 + 2Н20Карбоновые кислоты при действии восстановителей в присутствии катализаторов способны превращаться в альдегиды, спирты и даже …](https://fs1.ppt4web.ru/images/9703/89170/640/img14.jpg)