Презентация на тему: Химические свойства алкенов. Получение

Тема урока:Химические свойства алкенов. Получение.

Прогноз реакционной способности алкенов – наличие двойной связи позволяет отнести алкены к ненасыщенным соединениям. Превращение их в насыщенные возможно только в результате реакций присоединения, что является основной чертой химического поведения алкенов;– двойная связь представляет собой значительную концентрацию электронной плотности, поэтому реакции присоединения носят электрофильный характер; – двойная связь состоит из одной σ-связи, которая практически не поляризуется и одной π-связи, которая достаточно легко поляризуется.
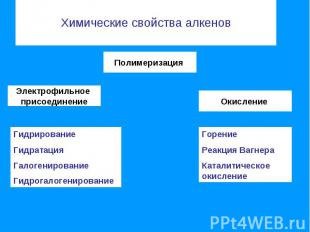
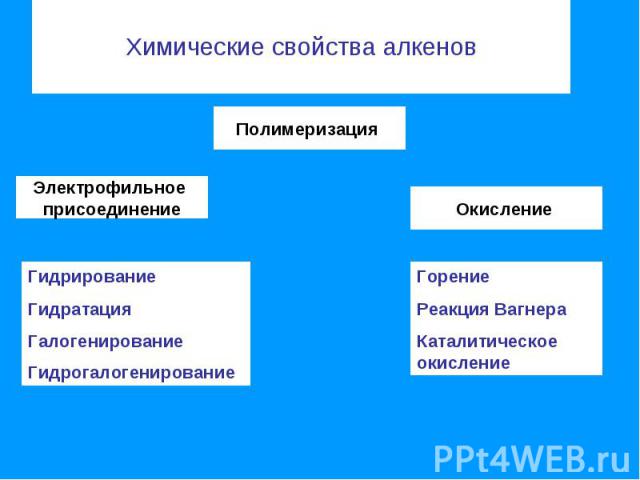
Химические свойства алкенов Полимеризация Электрофильное присоединение ГидрированиеГидратацияГалогенирование Гидрогалогенирование Горение Реакция ВагнераКаталитическое окисление
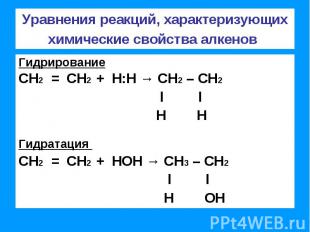
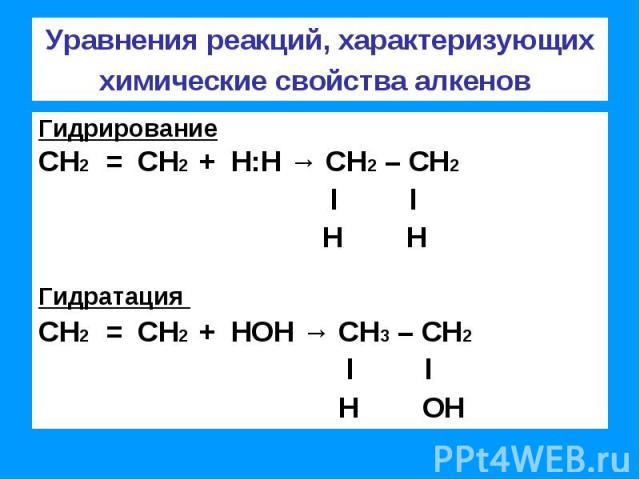
Уравнения реакций, характеризующих химические свойства алкенов ГидрированиеСН2 = СН2 + Н:Н → СН2 – СН2 l l Н НГидратация СН2 = СН2 + НОН → СН3 – СН2 l l Н ОН
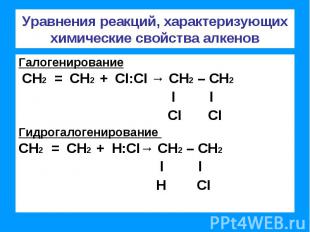
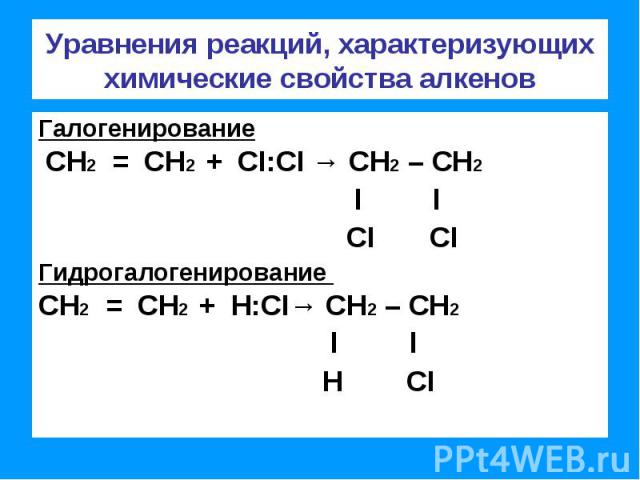
Уравнения реакций, характеризующих химические свойства алкенов Галогенирование СН2 = СН2 + CI:CI → СН2 – СН2 l l CI CIГидрогалогенирование СН2 = СН2 + Н:CI→ СН2 – СН2 l l Н CI

Качественная реакция на непредельные углеводороды (в т.ч. алкены) СН2 = СН2 + Br2 → СН2 – СН2 l l Br BrБромная вода, имеющая желтую окраску обесцвечивается
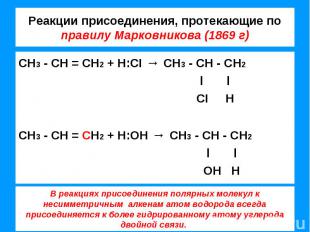
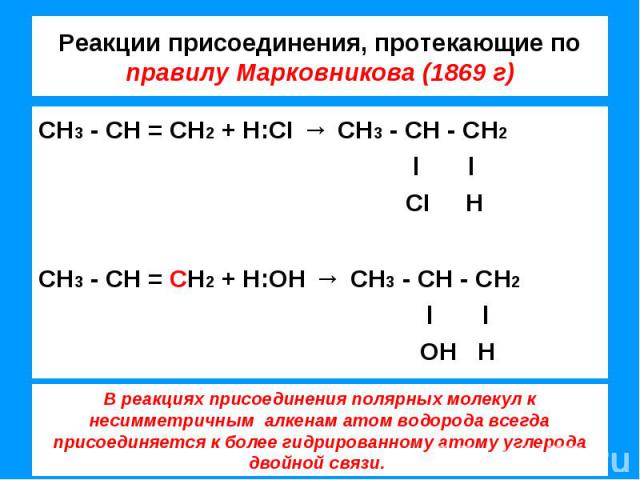
Реакции присоединения, протекающие по правилу Марковникова (1869 г) СН3 - СН = СН2 + Н:CI → СН3 - СН - СН2 l l CI НСН3 - СН = СН2 + Н:ОН → СН3 - СН - СН2 l l ОН Н В реакциях присоединения полярных молекул к несимметричным алкенам атом водорода всегда присоединяется к более гидрированному атому углерода двойной связи.
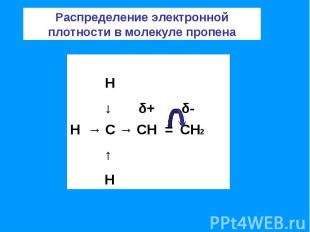
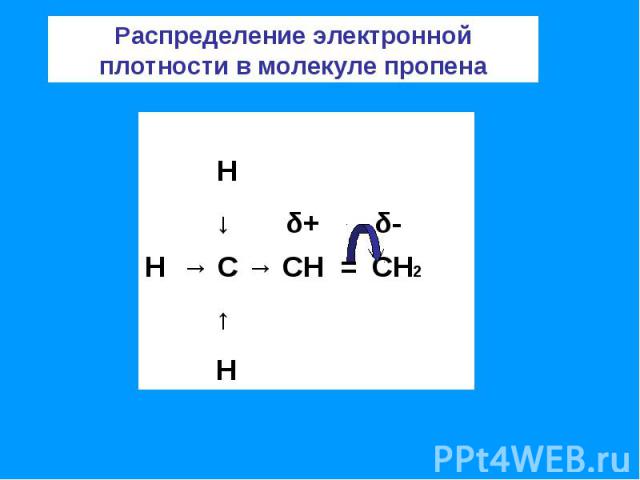
Распределение электронной плотности в молекуле пропена

Уравнения реакций, характеризующих химические свойства алкенов ОкислениеРеакция Вагнера3СН2 = СН2 + 4Н2О + 2KMnO4 = = 3СН2OH - СН2OH +2MnO2 + 2KOHКачественная реакция на кратную связь – обесцвечивание водного раствора перманганата калия(открыта Е.Е.Вагнером в 1888 г)

Уравнения реакций, характеризующих химические свойства алкенов Каталитическое окислениеВ присутствии хлоридов меди и палладия: 2СН2 = СН2 + О2 → 2 СН3 – СОН2. В присутствии серебра, при t 150-350 С2СН2 = СН2 + О2 → 2 СН2 – СН2 О

Уравнения реакций, характеризующих химические свойства алкенов Реакция полимеризации n(СН2 = СН2) → (- СН2 – СН2 -)n

Получение алкенов Промышленные способы1. Крекинг алкановС8Н18 → С4Н8 + С4Н10 2. Дегидрирование алкановСН3-СН2-СН2-СН3 → СН3-СН=СН-СН3 + Н2

Получение алкенов Лабораторные способы Дегалогенирование галогенпроизводных алкановДегидрогалогенирование галогенпроизводных алкановДегидратация спиртов
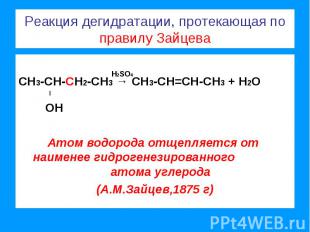
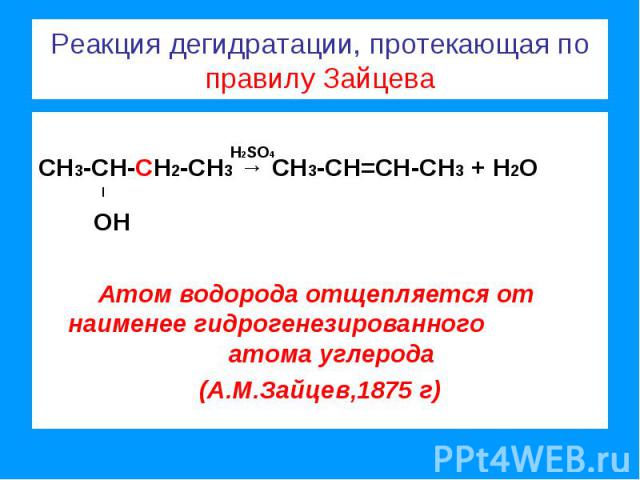
Реакция дегидратации, протекающая по правилу Зайцева СН3-СН-СН2-СН3 → СН3-СН=СН-СН3 + Н2О l ОНАтом водорода отщепляется от наименее гидрогенезированного атома углерода(А.М.Зайцев,1875 г)