Презентация на тему: Получение водорода в промышленности и его применение

Получение водорода в промышленности и его применение Химия 8 класс

Цель урока: Изучить способы получения водорода в лаборатории и промышленности. Рассмотреть основные области применения водорода.

Получение водорода в промышленности Очевидно, что при огромных объемах промышленного производства сырьем для получения водорода должны быть легкодоступные и дешевые вещества. Такими веществами являются природный газ (метан СН4) и вода. Запасы природного газа велики, а воды — практически не ограничены.

Получение водорода в промышленности 1. В основном получают из природного газа путем конверсии (превращения) под действием водяных паров и катализатора: СН4 + 2Н2О → 4Н2↑+СО2 2. Нагревание: CH4 →2H2↑ +C 3. Разложение воды под действием электрического тока: 2Н2О→Н2↑ +О2↑ В промышленности водород получают, пропуская водяные пары над раскаленным углем: С + Н20 = СО + Н2.
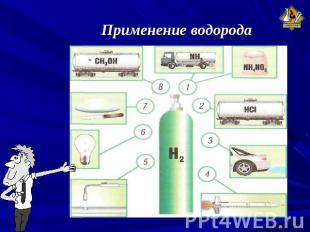
Применение водорода

Применение водорода 1 — производство минеральных удобрений 2 — получение соляной кислоты; 3 — водород — автомобильное топливо XXI века; 4 — топливо для ракетных двигателей; 5 — сварка и резка металлов; 6 — получение тугоплавких металлов; 7 — получение твердых жиров (маргарина); 8 — синтез метилового спирта и других органических продуктов.

Выводы: каменный

Домашнее задание Параграф 31, упр. на странице 134; повторить материал с 25-31 параграф включительно.

Список использованной литературы: Ерёмин В.В., А.А. Дроздов А.А., Н.Е. Кузьменко Н.Е., В.В. Лунин В.В. Химия 8 класс.-Москва: «Мир и образование», 2004. 304 стр. Химия для школьников, №1,2006.

Вопросы: Какие способы получения водорода используют в промышленности? Почему в лаборатории водород получают разложением воды с помощью электрического тока, а в промышленности этот способ используется редко? Перечислите свойства водорода, на основании которых он находит применение в различных областях деятельности человека.

Допиши химические реакции и укажи их тип: 1. H2O2 = 6. HgO= 2. S + O2= 7. Al + O2= 3. Al + HCl= 8. Zn + H2SO4= 4. HgO + H2= 9. PbO +H2 = 5. H2 + Cl2= 10. Na +H2=

Ответы: 1. H2O2=2H2O+O2 6. 2HgO=Hg+O2 2. S + O2=SO2 7.4Al +3O2=2Al2O3 3.2Al+6HCl=2AlCl3+3H2 8. Zn+H2SO4=ZnSO4+H2 4. HgO +H2=Hg+H2O 9. PbO +H2 =Pb+H2O 5. H2 + Cl2 =2HCl 10. 2Na + H2=2NaH

Типы реакций: 1 р-ция разложения 6 р-ция разложения 2 р-ция соединения 7 р-ция соединения 3 р-ция замещения 8 р-ция замещения 4 р-ция замещения 9 р-ция замещения 5 р-ция соединения 10 р-ция соединения

























