Презентация на тему: Свойства ковалентной связи

Свойства ковалентной связи ГибридизацияПоляризацияНаправленностьНасыщаемость

Насыщаемость Насыщаемость ковалентной связи определяеться числом общих электронных пар,которыми характерезуется тот или иной атом.Насыщенность,это полное использование атомом своих валентных орбиталей. В таких молекулах как CH4,Н2О, BCI3

Поляризуемость ковалентной связи. Изменение полярности молекулы,это неравномерное распределение электронной плотности в молекуле,например в молекуле HCI,электронная плотность около ядра хлора больше чем у водорода.Реальные заряды Hq- и CIq+,называются ЭФФЕКТИВНЫМИ зарядами.

Дипольный момент Для оценки полярности пользуются постоянным дипольным моментом м (мю), представляющим собой произведение эффективного заряда на длину диполя L(эль) м=qxl измеряеться в дебаях.Дипольные моменты имеют значение от 0 до 11D.

Полярность молекул.Полярность связей. На примере HCI,эти понятия совпадают! В таких молекулах чем больше разность ЭО, тем больше полярность связи и молекулы.В многоатомных молекулах связь полярная а молекула может быть полярной и неполярной.Например С+=>Oq-и молекула и связь полярны.О-qO-q векторы в противоположных направлениях,связь полярная,молекула неполярна равна 0.В молекуле Н2О атомы Н относительно О расположены под углом векторная сумма >0олекула полярна!
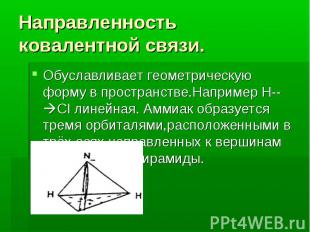
Направленность ковалентной связи. Обуславливает геометрическую форму в пространстве.Например H--CI линейная. Аммиак образуется тремя орбиталями,расположенными в трёх осях направленных к вершинам тригональной пирамиды.

Гибридизация валентных орбиталей. Гибридизация орбиталей– это смешение их и выравнивание по форме в форму неправильной восьмёрки и одинаковой энергии.При перекрывании гибридными орбиталями образуется прочная связь именуемая сигма.Гибридизация происходит между разными орбиталями S-- P

Тип гибридизации определяет форму молекулы SP гибридизация в молекуле изменяет форму две орбитали центрального атома S P. В молекуле BeCI2 Be)2 )2 1S2 2S2 2P02S1 2P1 CI p– s Be p—pCI sp электроны берилия гибридные.

Молекула метана и хлорида бора Атом С )2 ) 4 1S2 2 S2 2 P2--- 2S12P3В образовании молекулы участвуют S1 P3 Электрона образуя 4 простые связи

Хлоридa бораB)2)3 1S2 2S2 2P1-----2S1 2P2 CI CI------------ B CI