Презентация на тему: IV группа главная подгруппа. Углерод

IV группа главная подгруппаУглерод

Заряд ядра атома +62 энергетических уровня4 электрона на внешнем энергетическом уровне…2S22P2 – строение внешнего энергетического уровнядля завершения внешнего энергетического уровня атом может отдавать 4 электрона: С0 - 4е → С+4, выступает в роли восстановителядля завершения внешнего энергетического уровня атом может принимать 4 электрона: С0 + 4е → С-4, выступает в роли окислителя
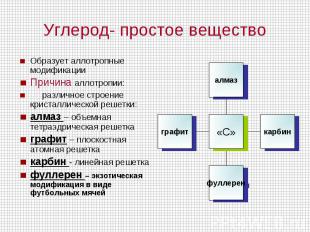
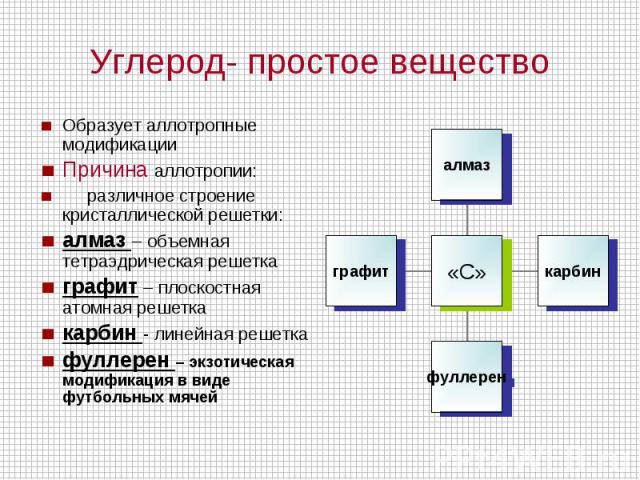
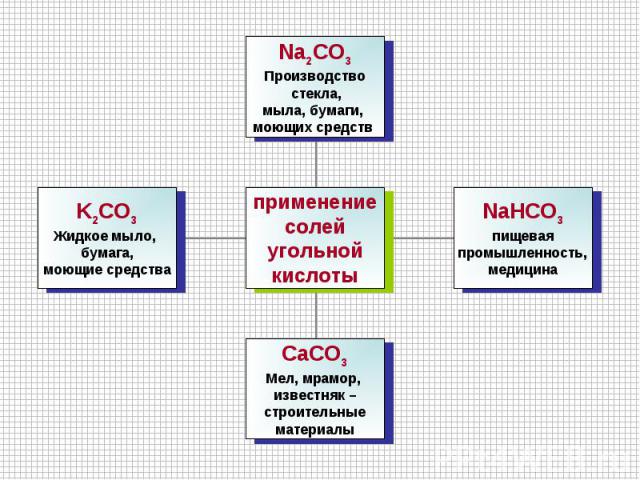
Углерод- простое вещество Образует аллотропные модификацииПричина аллотропии: различное строение кристаллической решетки:алмаз – объемная тетраэдрическая решеткаграфит – плоскостная атомная решеткакарбин - линейная решетка фуллерен – экзотическая модификация в виде футбольных мячей
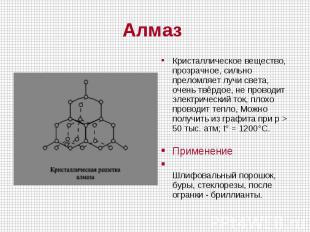
Кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит тепло, Можно получить из графита при p > 50 тыс. атм; t° = 1200°C. Применение Шлифовальный порошок, буры, стеклорезы, после огранки - бриллианты.
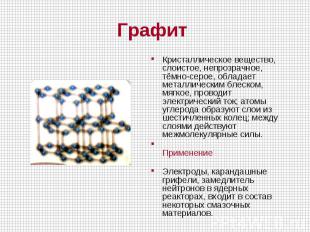
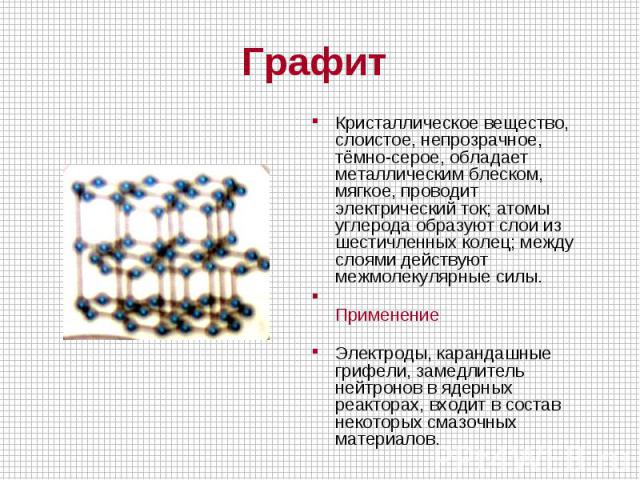
Кристаллическое вещество, слоистое, непрозрачное, тёмно-серое, обладает металлическим блеском, мягкое, проводит электрический ток; атомы углерода образуют слои из шестичленных колец; между слоями действуют межмолекулярные силы. Применение Электроды, карандашные грифели, замедлитель нейтронов в ядерных реакторах, входит в состав некоторых смазочных материалов.

Чёрный порошок; полупроводник.Состоит из линейных цепочек –CºC–CºC– и =С=С=С=С= При нагревании переходит в графит. Модель молекулы фуллерена

Адсорбция - поглощение газообразных или растворённых веществ поверхностью твёрдого вещества.Обратный процесс - выделение этих поглощённых веществ - десорбция. Применение адсорбции Очистка от примесей (в производстве сахара и др.), для защиты органов дыхания (противогазы), в медицине (таблетки "Карболен") и др.

Интересная история, произошедшая с учеными М.Фарадеем и Г. Дэви Путешествуя, они остановились в одном замке, во время беседы с хозяином этого замка случилось следующее:Герцог не верил, что алмаз состоит из углерода. Он снял свой перстень с алмазом и сказал: «Сожгите его, тогда поверю!» И, когда увидел результат, воскликнул: «Удивительно, мой алмаз испарился!»На что ученые ему твердо ответили: «Не испарился, а сгорел!»Был у герцога алмаз и не стало его….Вот что значит не верить ученым!

Углерод - малоактивен, на холоду реагирует только со фтором; химическая активность проявляется при высоких температурах.Восстановительные свойстваВзаимодействие с избытком кислорода: C0 + O2 → C+4O2 При недостатке кислорода образуется оксид углерода (II) 2C0 + O2 → 2C+2OВзаимодействие с фтором: С + 2F2 → CF4с водяным паром C0 + H2O → С+2O + H2 с оксидами металлов C0 + 2CuO → 2Cu + C+4O2с кислотами – окислителями: C0 + 2H2SO4(конц.) → С+4O2 + 2SO2 + 2H2O С0 + 4HNO3(конц.) → С+4O2 + 4NO2 + 2H2O

Окислительные свойствас некоторыми металлами образует карбиды 4Al + 3C0 → Al4C3 Ca + 2C0 → CaC2-4с водородом C0 + 2H2 → CH4Углерод – это особый химический элемент, он основа многообразия органических соединений, из которых построены все живые организмы на нашей планете.
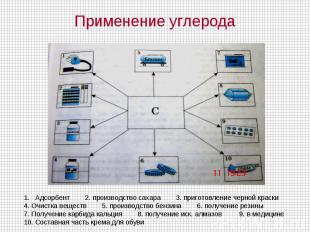
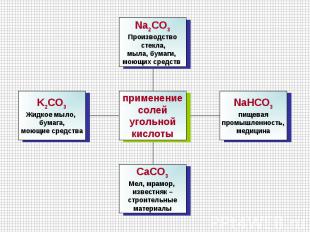
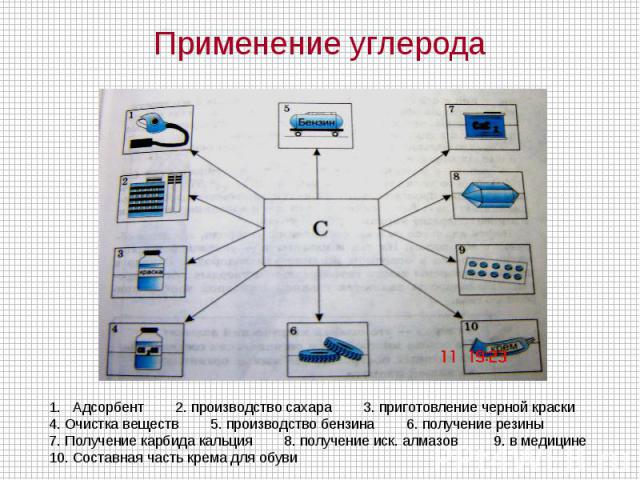
Применение углерода Адсорбент 2. производство сахара 3. приготовление черной краски4. Очистка веществ 5. производство бензина 6. получение резины 7. Получение карбида кальция 8. получение иск. алмазов 9. в медицине10. Составная часть крема для обуви

Соединения углерода Оксид углерода (II) CO Угарный газ; бесцветный, без запаха, малорастворим в воде, растворим в органических растворителях, ядовит, t°кип = -192°C; t пл. = -205°C.

В промышленности (в газогенераторах): C + O2→ CO2 CO2 + C → 2CO В лаборатории - термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.): HCOOH → H2O + CO H2C2O4 → CO2↑ + H2O + CO↑

При обычных условиях CO инертен; при нагревании – восстановитель; несолеобразующий оксид. Взаимодействие с кислородом 2C+2O + O2 → 2C+4O2↑ Взаимодействиес оксидами металлов C+2O + CuO → Сu + C+4O2↑ Взаимодействие с хлором (на свету) CO + Cl2 → COCl2(фосген) Реагирует с расплавами щелочей (под давлением) CO + NaOH → HCOONa (формиат натрия)

Оксид углерода (IV) СO2 O=C=Oуглекислый газ, бесцветный, без запаха, растворимость в воде – в 1V H2O растворяется 0,9 V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется "сухой лёд"); не поддерживает горение.

Получение оксида углерода (IV) Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка: CaCO3 → CaO + CO2↑ Действием сильных кислот на карбонаты и гидрокарбонаты: CaCO3 + 2HCl → CaCl2 + H2O + CO2↑ NaHCO3 + HCl → NaCl + H2O + CO2↑
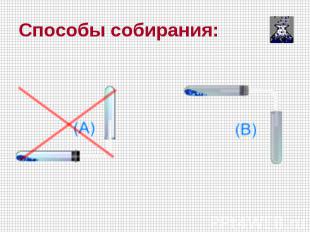
Способы собирания:

Кислотный оксид: реагирует с основными оксидами и основаниями, образуя соли угольной кислоты Na2O + CO2 → Na2CO3 2NaOH + CO2 → Na2CO3 + H2O NaOH + CO2 → NaHCO3 При повышенной температуре может проявлять окислительные свойства С+4O2 + 2Mg → 2Mg+2O + C0 Качественная реакция - помутнение известковой воды: Ca(OH)2 + CO2 → CaCO3↓+ H2O (белый осадок)При длительном пропускании CO2 через известковую воду осадок исчезает, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат: CaCO3 + H2O + CO2→ Сa(HCO3)2

Кислота слабая, неустойчивая, существует только в водном растворе: CO2 + H2O ↔ H2CO3Двухосновная: H2CO3 ↔ H+ + HCO3- HCO3- ↔ H+ + CO32-Характерны все свойства кислот.Cредние соли - карбонаты Кислые соли - гидрокарбонаты (HCO3-).Карбонаты и гидрокарбонаты могут превращаться друг в друга: 2NaHCO3 → Na2CO3 + H2O + CO2↑Na2CO3 + H2O + CO2 → 2NaHCO3

Карбонаты металлов (кроме щелочных металлов) при нагревании разлагаются с образованием оксида: CuCO3 → CuO + CO2↑Качественная реакция - "вскипание" при действии сильной кислоты: Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑ CO32- + 2H+ → H2O + CO2↑