Презентация на тему: Изучение реакции среды в зависимости от типа гидролиза соли

Применение модульной системы экспериментов PROLog на уроках химии


Лабораторная работа Изучение реакции среды в зависимости от типа гидролиза соли. Цели: понять сущность гидролиза. научиться определять реакцию и тип среды раствора электролита на основании состава соли; писать уравнения реакций гидролиза.

Инновационное. Цифровой измерительный модуль рН Оборудование и материалы.

Традиционное. Лабораторный штатив Муфта и лапка Стакан химический 100мл Стакан химический 50 мл Оборудование и материалы.

Дополнительные материалы. NaCL - 0,1M раствор Na2CO3 - 0,1M раствор ALCL3 - 0,1M раствор Pb(CH3COO)2 - 0,1M раствор Дистилированная вода Оборудование и материалы.

Гидролиз – процесс взаимодействия соли с водой, в результате которого идет образование слабого электролита. Причиной его является ЭД соли и воды на ионы и взаимодействия между ними. Соли, образованные сильными основаниями и сильными кислотами, гидролизу не подвергаются. Гидролизу подвергаются растворимые соли, в состав которых входит либо катион слабого электролита, либо анион слабого электролита. Введение.

Гидролизу подвергаются растворы солей. Следовательно, водные растворы солей имеют разные значения рН и различные типы сред: Кислотную (рН7). Нейтральную (рН=7).
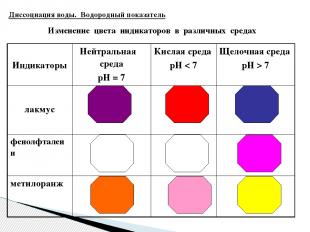
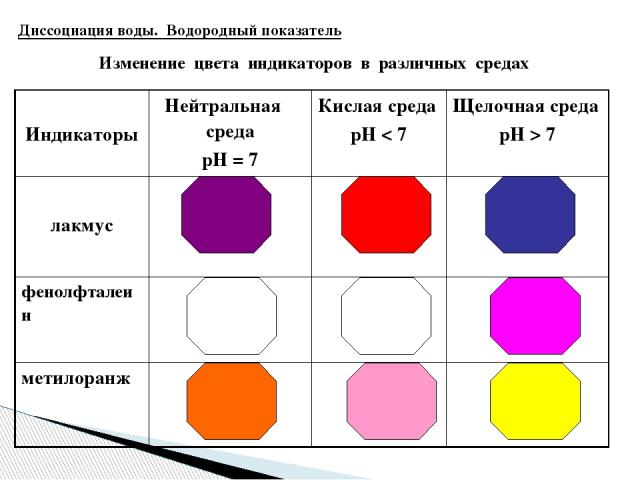
Изменение цвета индикаторов в различных средах Диссоциация воды. Водородный показатель Индикаторы Нейтральная среда рН = 7 Кислая среда рН7 лакмус фенолфталеин метилоранж

Общие правила ТБ при проведению лабораторных работ в кабинете химии. Правила обращения со стеклянной посудой. Правила обращения с реактивами. Правила обращения с измерительными модулями, в частности с модулем «рН». Правила по технике безопасности.

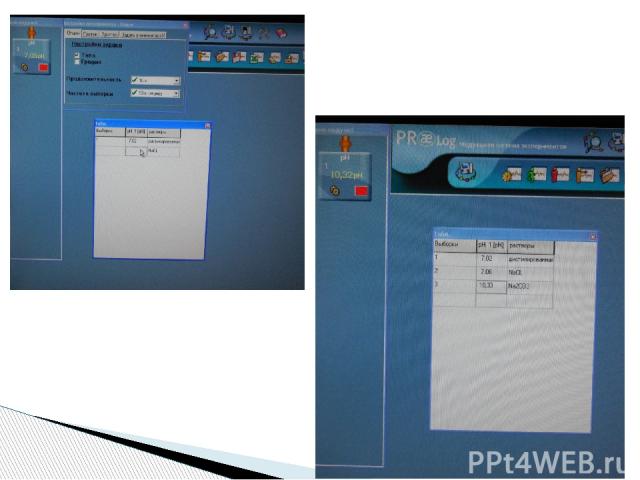
Порядок проведения работы Значение «рН» в растворах солей Раствор рН(индикатор) рН(модуль) Дистиллированная вода Хлорид натрия Карбонат натрия Хлорид алюминия Ацетат свинца

Собрать установку по схеме.
Подключение модуля сопряжения USB к ПК

Установка модуля

Исследование и измерение

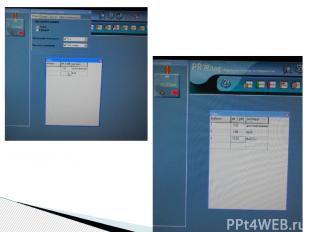

Традиционный метод определения среды раствора


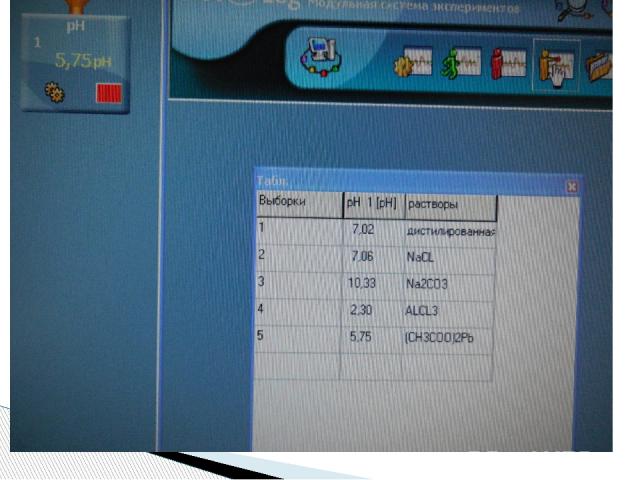
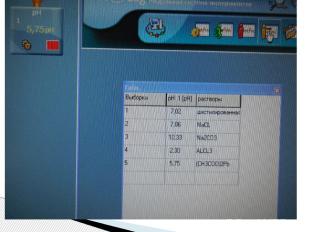
Сравнение результатов разных способов исследования среды растворов. Значение «рН» в растворах солей Раствор рН(индикатор) рН(модуль) Дистиллированная вода Нейтральная 7,02 Хлорид натрия Нейтральная 7,06 Карбонат натрия Щелочная 10,33 Хлорид алюминия Кислая 2,30 Ацетат свинца Слабокислая 5,75

Проанализируйте данные в отчетной таблице и данные полученные традиционным способом. Ответьте на контрольные вопросы. Сделайте вывод по работе. Анализ результатов лабораторной работы

Какие из исследуемых растворов солей имеют кислую среду, а какие щелочную? В каких растворах среда будет нейтральная? Ответ обоснуйте. Напишите уравнение диссоциации исследуемых растворов солей. Напишите уравнения реакции гидролиза исследуемых растворов солей. Контрольные вопросы

Гидролиз – процесс взаимодействия ионов соли с ионами воды с изменением рН среды. Выводы: Обязательное условие гидролиза – образование слабого электролита Характер среды раствора соли зависит от иона, который подвергается гидролизу (по катиону или по аниону)

Определять характер среды раствора соли и объяснять результаты с помощью ионного и молекулярного уравнения гидролиза Более глубоко характеризовать свойства солей как электролитов В результате урока мы умеем: Делать логические выводы из наблюдений В повседневной жизни использовать полученные знания по этой теме.