Презентация на тему: ГИДРОЛИЗ И ЭЛЕКТРОЛИЗ



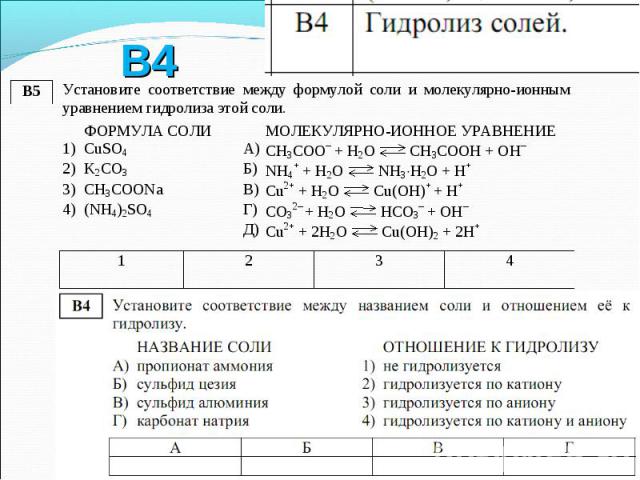
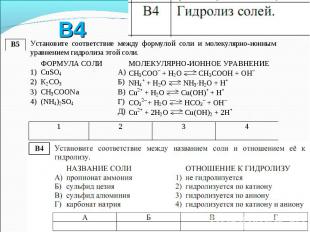
1. Соль растворима 1. Соль растворима 2. Наличие катиона или аниона слабой кислоты или основания.

1. Обратимо 1. Обратимо 2. Максимум на 5-15% (если не происходит параллельных процессов) 3. Только по 1-й ступени (если не происходит параллельных процессов)

1) Раствор ацетата аммония: 1) Раствор ацетата аммония: CH3COONH4 CH3COOH + NH3 (равновесие существует, т.к. оба продукта гидролиза хорошо растворимы) Характер среды определяется соотношением силы кислоты и основания

2) Необратимый гидролиз 2) Необратимый гидролиз Попытка получить водный раствор сульфида алюминия обречена: Al2S3 + 6H2O = 2Al(OH)3 + 3H2S (оба продукта гидролиза малорастворимы и уводятся из раствора; равновесия нет). Таким солям, как Al2S3, в таблице растворимости соответствует прочерк.



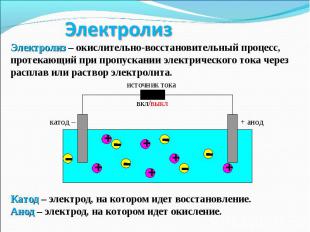

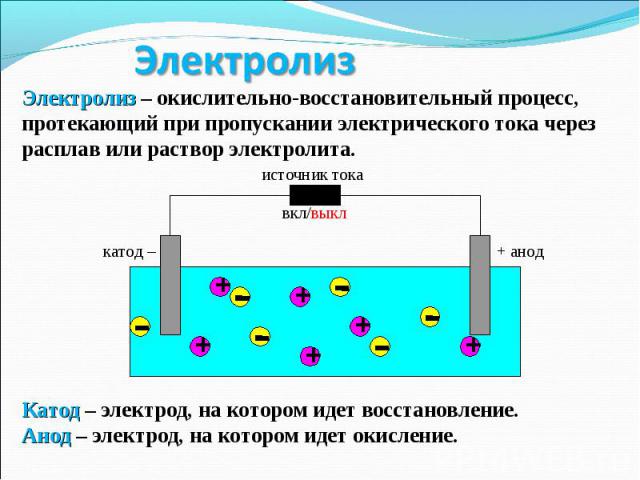
При электролизе расплава на катоде всегда восстанавливается катион электролита, а на аноде всегда окисляется анион электролита. При электролизе расплава на катоде всегда восстанавливается катион электролита, а на аноде всегда окисляется анион электролита. KF K+ + F- Катод: K+ + e = K 2 восстановление Анод: 2F- 2e = F2 1 окисление 2K+ + 2F- = 2K + F2 Итоговое уравнение реакции: 2KFрасплав 2K + F2 Кислородсодержащие анионы претерпевают на аноде разрушение, например: SO42- 2e = SO3 + ½ O2 CO32- 2e = CO2 + ½ O2
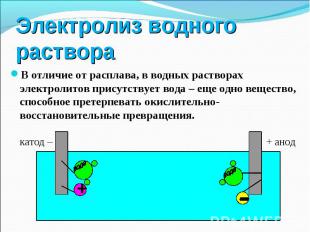
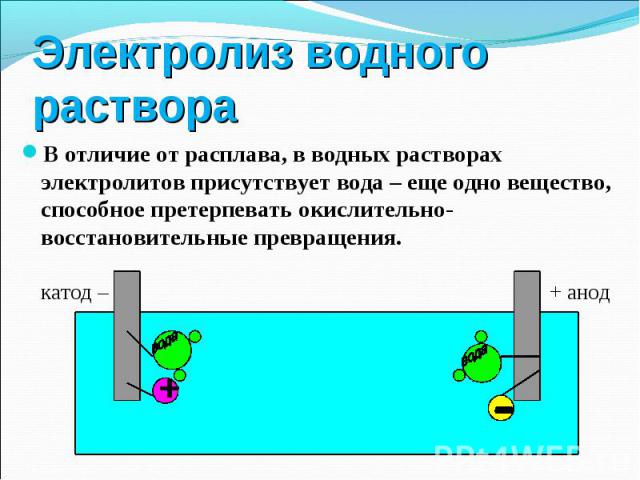
В отличие от расплава, в водных растворах электролитов присутствует вода – еще одно вещество, способное претерпевать окислительно-восстановительные превращения. В отличие от расплава, в водных растворах электролитов присутствует вода – еще одно вещество, способное претерпевать окислительно-восстановительные превращения.

Процесс на катоде зависит от положения катиона металла в электрохимическом ряду напряжений. Процесс на катоде зависит от положения катиона металла в электрохимическом ряду напряжений.

Процесс на аноде зависит от: Процесс на аноде зависит от: 1) материала анода. Если анод растворим в условиях электролиза, то происходит окисление материала анода: М – ne = Mn+. Электролиз раствора NaCl с медным анодом: NaCl Na+ + Cl- Катод: Сu2+ + 2e = Cu Анод (Сu): Сu – 2e = Cu2+

Процесс на аноде зависит от: Процесс на аноде зависит от: 2) природы аниона. 2RCOO- – 2e = R-R + 2CO2.

CuSO4 Cu2+ + SO42- CuSO4 Cu2+ + SO42- Катод: Cu2+ + 2e = Cu 2 Анод: 2Н2О – 4е = О2 + 4Н+ 1 2Сu2+ + 2H2O = 2Cu + O2 + 4H+ 2СuSO4 + 2H2O 2Сu + О2 + 2H2SO4 NaCl Na+ + Cl- Катод: 2Н2О + 2е = Н2 + 2ОН- 1 Анод: 2Cl- – 2e = Cl2 1 2Сl- + 2H2O = Cl2 + H2 + 2OH- 2NaCl + 2H2O 2NaOH + H2 + Cl2

KF K+ + F- KF K+ + F- Катод: 2Н2О + 2е = Н2 + 2ОН- 2 Анод: 2Н2О – 4е = О2 + 4Н+ 1 6Н2О = 2Н2 + О2 + 4ОН- + 4Н+ 6Н2О = 2Н2 + О2 + 4Н2О 2Н2О = 2Н2 + О2 2Н2О 2Н2 + О2