Презентация на тему: Неметаллы, особенности строения


Какой химический элемент входит в состав любого органического вещества? Какой химический элемент входит в состав любого органического вещества? УГЛЕРОД

ФОСФОР

ВОДОРОД И ГЕЛИЙ

КИСЛОРОД

ВОДОРОД


Н, В, С, О, Р, F, S, N, He, Si Н, В, С, О, Р, F, S, N, He, Si




Запишите в тетрадях вопросы, которые вы хотите узнать о неметаллах, используя: Запишите в тетрадях вопросы, которые вы хотите узнать о неметаллах, используя: А) «тонкие» вопросы (где, кто, что, когда, как); Б) «толстые» вопросы (зачем , почему)

У атомов неметаллов внешняя электронная оболочка содержит много ( от 4 до 7) электронов( исключение атом гелия, у которого 2 электрона) У атомов неметаллов внешняя электронная оболочка содержит много ( от 4 до 7) электронов( исключение атом гелия, у которого 2 электрона)

И стремится к завершению либо путем принятия недостающих электронов (тогда неметалл - окислитель) , либо путем отдачи электронов ( тогда неметалл - восстановитель). И стремится к завершению либо путем принятия недостающих электронов (тогда неметалл - окислитель) , либо путем отдачи электронов ( тогда неметалл - восстановитель).

Если на внешней электронной оболочке 8 электронов это инертный газ. Если на внешней электронной оболочке 8 электронов это инертный газ.

заряд ядра увеличивается; радиусы атомов уменьшаются; число электронов на внешнем слое увеличивается; число валентных электронов увеличивается; электроотрицательность увеличивается; окислительные (неметаллические) свойства усиливаются (кроме элементов VIIIA группы).

заряд ядра увеличивается; заряд ядра увеличивается; радиус атома увеличивается; электроотрицательность уменьшается; число валентных электронов не изменяется; число внешних электронов не изменяется (за исключением водорода и гелия); окислительные (неметаллические) свойства ослабевают (кроме элементов VIIIA группы).

Большинство неметаллов - простые вещества, в которых атомы связаны ковалентными связями; в благородных газах химических связей нет. Среди неметаллов есть как молекулярные, так и немолекулярные вещества. Все это приводит к тому, что физических свойств, характерных для всех неметаллов, нет. Большинство неметаллов - простые вещества, в которых атомы связаны ковалентными связями; в благородных газах химических связей нет. Среди неметаллов есть как молекулярные, так и немолекулярные вещества. Все это приводит к тому, что физических свойств, характерных для всех неметаллов, нет.

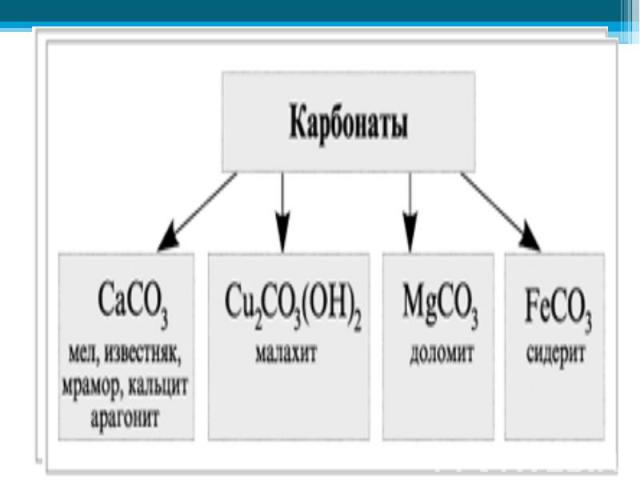
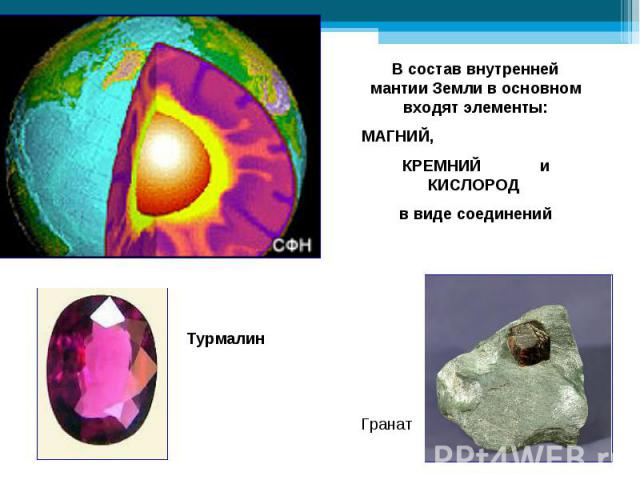
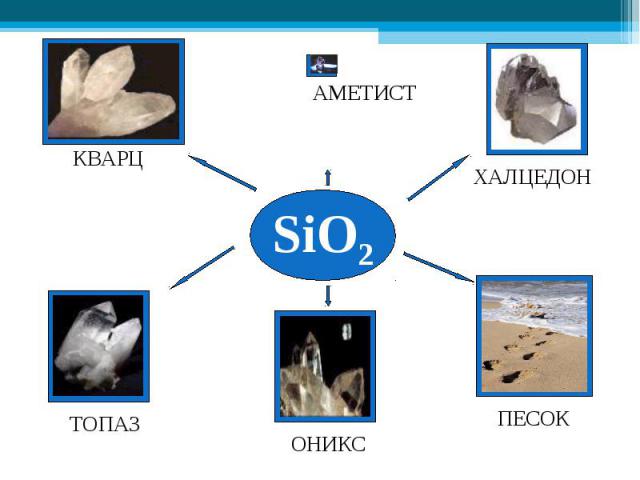
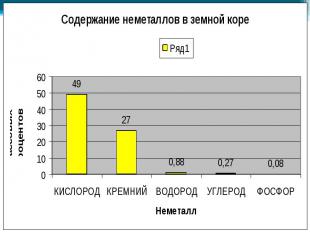
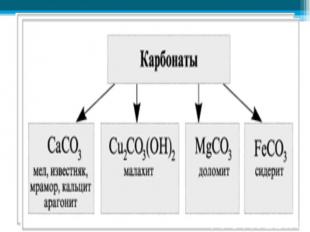
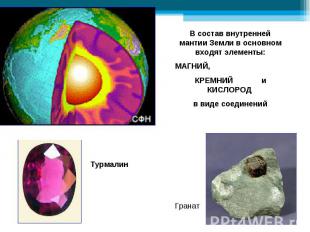
В природе встречаются самородные неметаллы N2 и O2 (в воздухе), сера (в земной коре), но чаще неметаллы в природе находятся в химически связанном виде. В первую очередь это вода и растворённые в ней соли, затем минералы и горные породы (например различные силикаты, алюмосиликаты, фосфаты, бораты, сульфаты и карбонаты). В природе встречаются самородные неметаллы N2 и O2 (в воздухе), сера (в земной коре), но чаще неметаллы в природе находятся в химически связанном виде. В первую очередь это вода и растворённые в ней соли, затем минералы и горные породы (например различные силикаты, алюмосиликаты, фосфаты, бораты, сульфаты и карбонаты). По распространенности в земной коре неметаллы занимают самые различные места: от трех самых распространенных элементов (O, Si, H) до весьма редких (As, Se, I, Te).




Фтор-F2 Флюорит -CaF2 Фтор-F2 Флюорит -CaF2
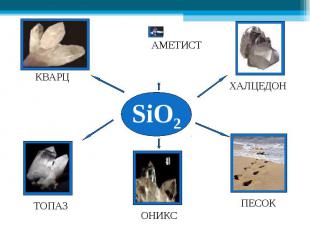

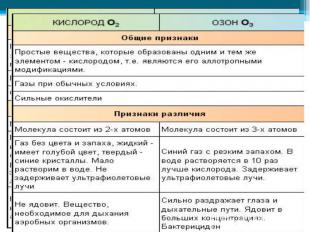
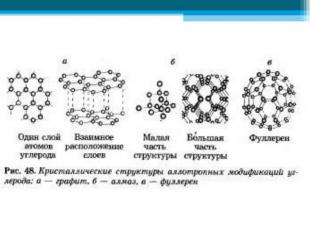
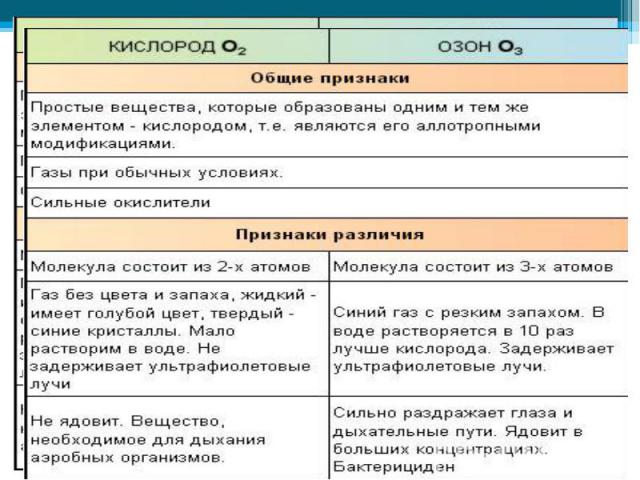
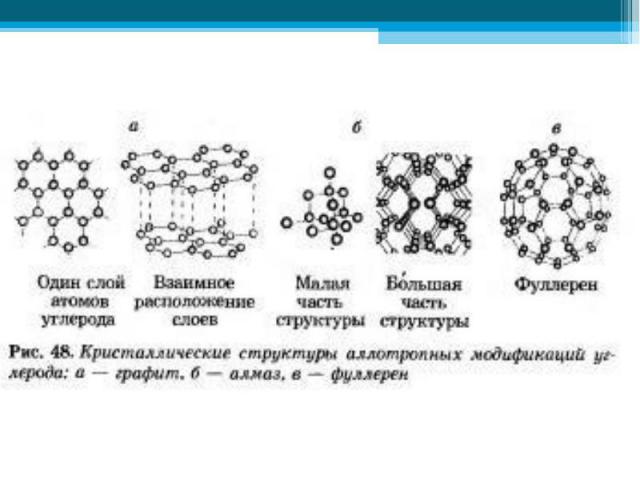
Аллотро пия (от др-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам: так называемых аллотропических модификаций или аллотропических форм. Аллотро пия (от др-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам: так называемых аллотропических модификаций или аллотропических форм.