Презентация на тему: Оксиген. Кисень


Мета уроку: Ознайомити учнів з хімічним елементом оксигеном; Дати загальну характеристику простій речовині кисню за планом: знаходження в природі; фізичні властивості хімічні властивості; добування; застосування Сформувати поняття про оксиди, окиснення, горіння; З’ясувати умови виникнення та припинення горіння; ознайомитись з заходами протипожежної безпеки.

Цілі: Загальна характеристика елементу оксигену; Характеристика прості речовині кисню за планом: знаходження в природі; фізичні властивості хімічні властивості; добування; застосування

Елемент оксиген. Елемент оксиген знаходиться в VI групі, головній підгрупі, II періоді, порядковий номер № 8, Ar = 16. В=ІІ

Проста речовина КИСЕНЬ

Знаходження кисню в природі У земній корі його 49% по масі, в гідросфері - 89% по масі. 5. У складі повітря (у вигляді простого речовини) - 20-21% за об'ємом. Склад повітря: О2 - 20-21%; N2 - 78%; CO2 - 0,03%, Кисень є найпоширенішим елементом нашої планети. За вагою на його частку припадає приблизно половина загальної маси всіх елементів земної кори.

Физичні властивості Газ - без кольру, вкусу та запаху; в 100V H2O розчиняється 3V O2 (н.у.); t кип= -183 С; t пл = -219 C; Під тиском 760 мм. рт.ст. і температурі –183 С кисень зріджується
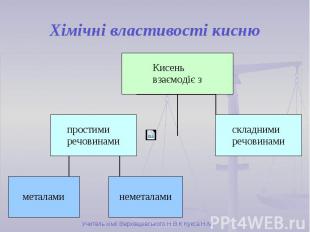
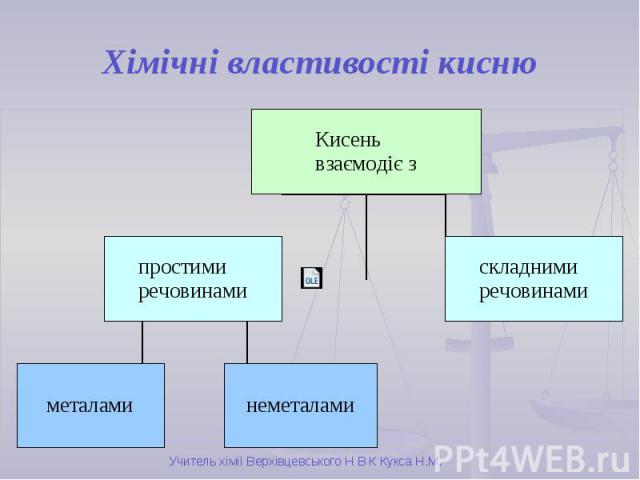
Хімічні властивості кисню

Хімічні властивості кисню Унаслідок взаємодії речовин із киснем утворюються бінарні сполуки, до складу яких входить Оксиген. Такі сполуки називають оксидами. Взаємодія речовин з киснем належить до реакцій окиснення. Горіння – це хімічна реакція, під час якої відбувається окиснення речовин з виділенням тепла і світла.

Горіння неметалів Взаємодія кисню з сіркою: S + О2 → SO2 Взаємодія кисню з фосфором: 4P + 5О2 → 2P2O5 Завдяки утворенню густого білого диму Р2О5 цю реакцію використовують для створення димової завіси

Горіння металів Взаємодія кисню з магнієм: 2Mg + О2 → 2MgO Цю реакцію раніше використовували фотографи для створення спалаху. Взаємодія кисню з залізом: 2Fe + О2 → 2FeO Цю реакцію можна спостерігати на будівництвах під час різання та зварюванню металів.

Взаємодія кисню зі складними речовинами Горіння складних речовин принципово не відрізняється від горіння простих речовин. При горінні складних речовин утворюються оксиди всіх елементів, які входять до складу цієї речовини.
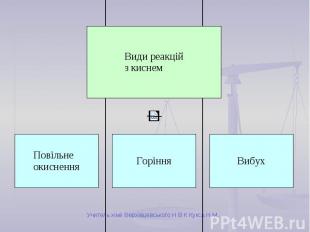

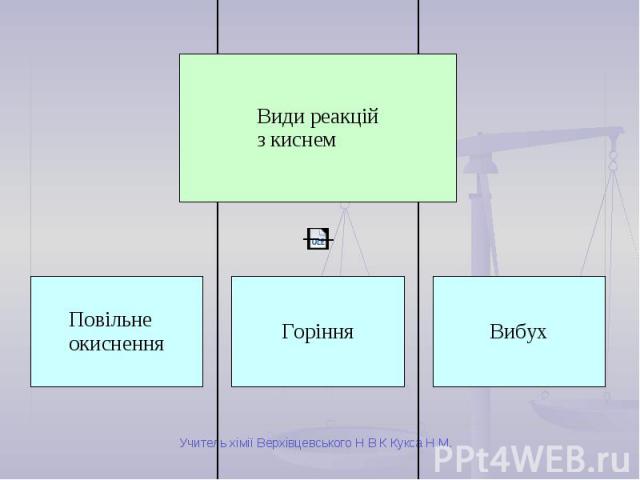
Повільне окиснення Відбувається повільно. Теплота виділяється поступово. Не супроводжується полум’ям. Приклади: Залізні предмети з часом вкриваються іржею. Скисання молока або сока. Ваші приклади.

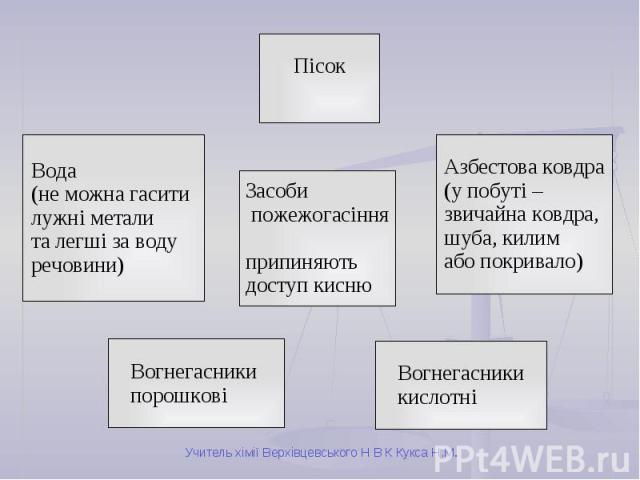
Вибух Відбувається дуже швидко. Енергія, що виділяється, призводить до руйнівних наслідків. Супроводжується вибуховою хвилею та іноді короткочасним спалахом. Приклади: Суміш кисню з воднем (гримучий газ). Суміші природного газу або вугільного пилу з повітрям. Тирса, просочена рідким киснем (вибухівка).

Горіння Відбувається швидко. Виділяється велика кількість теплоти. Найчастіше супроводжується полум’ям. Умови виникнення: вільний доступ кисню; досягнення температури займання; наявність горючої речовини.
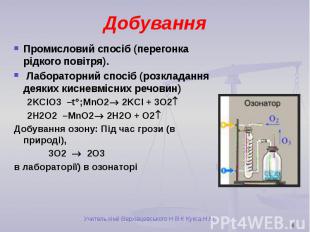
Добування Промисловий спосіб (перегонка рідкого повітря). Лабораторний спосіб (розкладання деяких кисневмісних речовин) 2KClO3 –t ;MnO2 2KCl + 3O2 2H2O2 –MnO2 2H2O + O2 Добування озону: Під час грози (в природі), 3O2 2O3 в лабораторії) в озонаторі

Застосування кисню: В медицині для полегшення дихання. Для дихання під водою та в космосі При газозварюванні металів: Для прискорювання хімічних реакцій в металургії. Рідкий кисень застосовують у реактивних двигунах.