Презентация на тему: Белки плазмы крови, их биологическая роль. Методы разделения белков плазмы крови. Диспротеинемии

Белки плазмы крови, их биологическая роль. Методы разделения белков плазмы крови. Диспротеинемии. Выполнила студентка 6 курса МБФ Баёва Елена

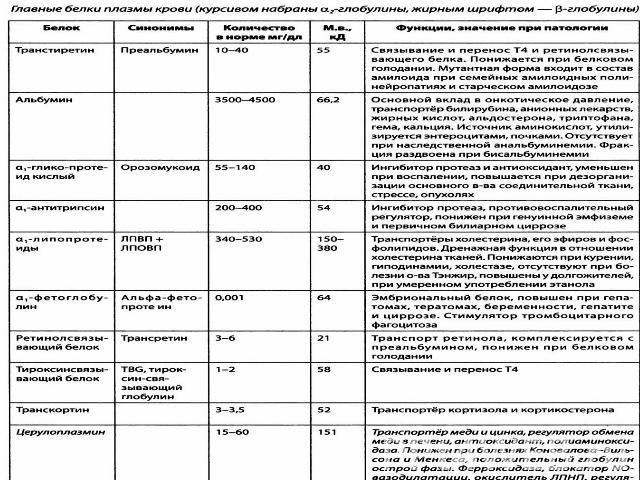
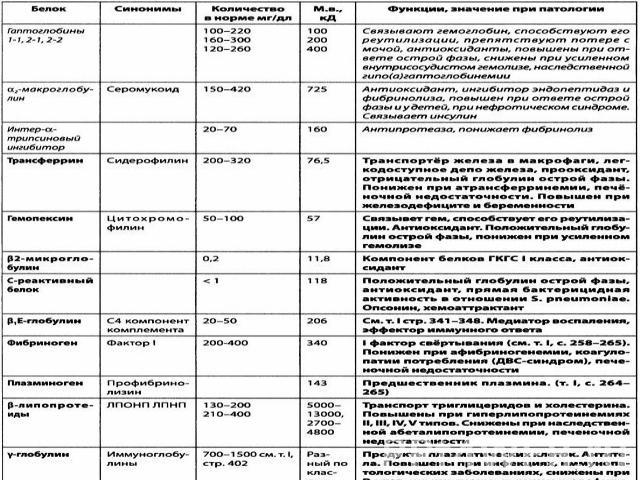
В плазме крови содержится 7% всех белков организма при концентрации 60 - 80 г/л. Из 9–10% сухого остатка плазмы крови на долю белков приходится 6,5–8,5%. Белки плазмы крови можно разделить на три группы: альбуминыглобулиныфибриноген Нормальное содержание альбуминов в плазме крови составляет 40–50 г/л, глобулинов – 20–30 г/л, фибриногена – 2-4 г/л.Синтез белков плазмы крови осуществляется преимущественно в клетках печени и ретикулоэндотелиальной системы

Физиологическая роль белков плазмы крови многогранна: Белки поддерживают коллоидно-осмотическое давление и тем самым постоянный объем крови(белки, являясь коллоидами, связывают воду и задерживают ее, не позволяя выходить из кровяного русла) Белки плазмы принимают активное участие в свёртывании кровиБелки плазмы определяют вязкость крови, которая играет важную роль в поддержании гемодинамических отношений в кровеносной системе. Принимают участие в поддержании постоянного рН крови, так как составляют одну из важнейших буферных систем. транспортная функция - альбумин, транстиретин, транскортин, трансферрин (перенос веществ, лекарственных средств)играют важную роль в процессах иммунитета (Иммуноглобулины)В результате образования с белками недиализируемых комплексов поддерживается уровень катионов в крови. Например, 40–50% кальция сыворотки связано с белками, значительная часть железа, магния, меди и других элементов также связана с белками сыворотки. Белки плазмы могут служить резервом аминокислот


Методы разделения белков плазмы Используя метод высаливания нейтральными солями, обнаруживается три фракции : альбумины, глобулины и фибриноген В сыворотке крови здорового человека при электрофорезе на бумаге можно обнаружить 5 фракций: альбумины, α1-, α2-, β-, γ-глобулины. Методом электрофореза в агаровом геле в сыворотке выделяют 7– 8 фракций, а при электрофорезе в крахмальном или полиакриламидном геле – до 16–17 фракций. Еще большее число белковых фракций (свыше 30) можно получить методом иммуноэлектрофореза. Этот метод подразумевает проведение электрофореза и реакции преципитации в одной среде, т.е. непосредственно на гелевом блоке. При данном методе с помощью серологической реакции преципитации достигается значительное повышение аналитической чувстительности электрофоретического метода.
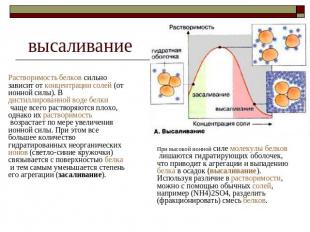
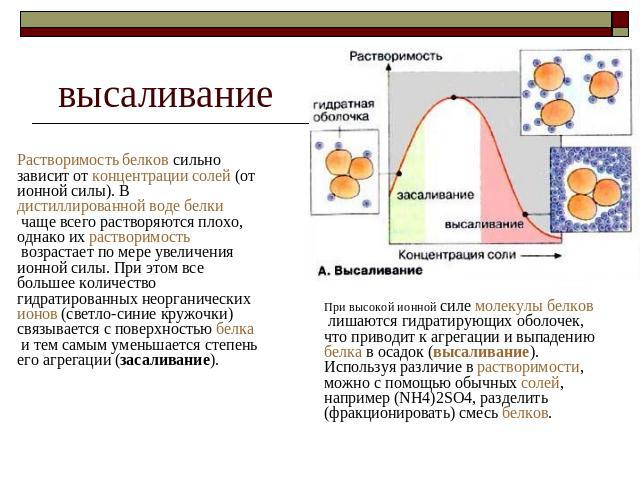
высаливание Растворимость белков сильно зависит от концентрации солей (от ионной силы). В дистиллированной воде белки чаще всего растворяются плохо, однако их растворимость возрастает по мере увеличения ионной силы. При этом все большее количество гидратированных неорганических ионов (светло-синие кружочки) связывается с поверхностью белка и тем самым уменьшается степень его агрегации (засаливание). При высокой ионной силе молекулы белков лишаются гидратирующих оболочек, что приводит к агрегации и выпадению белка в осадок (высаливание). Используя различие в растворимости, можно с помощью обычных солей, например (NН4)2SО4, разделить (фракционировать) смесь белков.

Диализ Для отделения низкомолекулярных примесей или замены состава среды используют диализ. Метод основан на том, что молекулы белкаиз-за своих размеров не могут проходить через полупроницаемые мембраны, в то время как низкомолекулярные веществаравномерно распределяются между объемом, ограниченным мембраной, и окружающим раствором. После многократной замены внешнего раствора состав среды в диализном мешочке (концентрация солей, величина pH и др.) будет тот же, что и в окружающемрастворе.
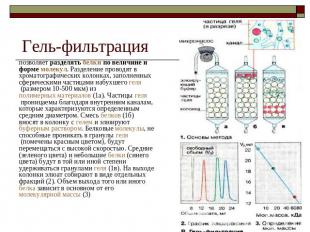
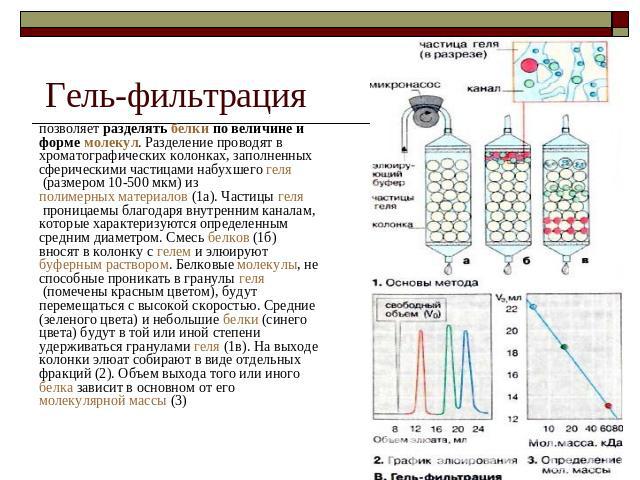
Гель-фильтрация позволяет разделять белки по величине и форме молекул. Разделение проводят в хроматографических колонках, заполненных сферическими частицами набухшего геля (размером 10-500 мкм) из полимерных материалов (1а). Частицы геля проницаемы благодаря внутренним каналам, которые характеризуются определенным средним диаметром. Смесь белков (1б) вносят в колонку с гелем и элюируют буферным раствором. Белковые молекулы, не способные проникать в гранулы геля (помечены красным цветом), будут перемещаться с высокой скоростью. Средние (зеленого цвета) и небольшие белки (синего цвета) будут в той или иной степени удерживаться гранулами геля (1в). На выходе колонки элюат собирают в виде отдельных фракций (2). Объем выхода того или иного белка зависит в основном от его молекулярной массы (3)

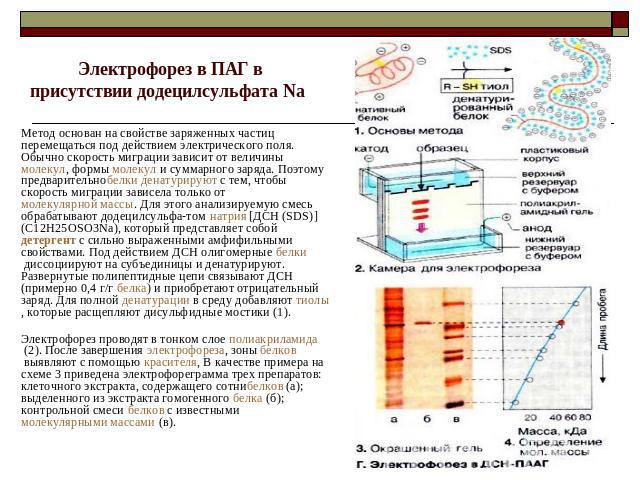
Электрофорез в ПАГ в присутствии додецилсульфата Na Метод основан на свойстве заряженных частиц перемещаться под действием электрического поля. Обычно скорость миграции зависит от величины молекул, формы молекул и суммарного заряда. Поэтому предварительнобелки денатурируют с тем, чтобы скорость миграции зависела только от молекулярной массы. Для этого анализируемую смесь обрабатывают додецилсульфа-том натрия [ДСН (SDS)] (C12H25OSO3Na), который представляет собой детергент с сильно выраженными амфифильными свойствами. Под действием ДСН олигомерные белки диссоциируют на субъединицы и денатурируют. Развернутые полипептидные цепи связывают ДСН (примерно 0,4 г/г белка) и приобретают отрицательный заряд. Для полной денатурации в среду добавляют тиолы, которые расщепляют дисульфидные мостики (1).Электрофорез проводят в тонком слое полиакриламида (2). После завершения электрофореза, зоны белков выявляют c помощью красителя, В качестве примера на схеме 3 приведена электрофореграмма трех препаратов: клеточного экстракта, содержащего сотнибелков (а); выделенного из экстракта гомогенного белка (б); контрольной смеси белков с известными молекулярными массами (в).

Иммуноэлектрофорез

Диспротеинемии Нарушения протеинограммы плазмы известны как диспротеинемии. К диспротеинемиям относятся увеличение концентрации белков плазмы (гиперпротеинемией), уменьшение этих концентраций (гипопротеинемии) и появление в плазме необычных белков, в норме не присутствующих там (парапротеинемии). Если изменения относятся только к глобулиновым фракциям, говорят о дисглобулинемиях.

Гиперпротеинемия Увеличение общего белка в сыворотке крови может быть относительным и абсолютным.Относительная гиперпротеинемия связана с уменьшением содержания воды в сосудистом русле, к чему могут приводить следующие состояния:тяжелые ожоги;генерализованный перитонит;непроходимость кишечника;неукротимая рвота;профузный понос;несахарный диабет;хронический нефрит;усиленное потоотделение;диабетический кетоацидоз.

Гиперпротеинемия Абсолютная гиперпротеинемия встречается редко. При этом увеличение общего белка в сыворотке крови может быть связано с синтезом патологических белков (парапротеинов), повышением синтеза иммуноглобулинов или усиленном синтезе белков острой фазы воспаления. Абсолютная гиперпротеинемия наблюдается при следующих заболеваниях:парапротеинемических гемобластозах (миеломная болезнь, болезнь Вальденстрема, болезнь тяжелых цепей) — отмечается значительное — до 120 — 160 г/л - возрастание концентрации общего белка;болезни Ходжкина;хроническом полиартрите;активном хроническом гепатите;острых и хронических инфекциях;аутоиммунных заболеваниях;саркоидозе;циррозе печени без выраженной печеночно-клеточной недостаточности

Гипопротеинемия ГипопротеинемияСнижение концентрации общего белка в сыворотке крови также может быть относительным и абсолютным.Относительная гипопротеинемия, как правило, связана с увеличением объема воды в кровеносном русле и наблюдается при следующих состояниях:водной нагрузке («водном отравлении»);прекращении отделения мочи (анурии);уменьшении диуреза (олигурии);внутривенном введении больших количеств раствора глюкозы больным с нарушенной выделительной функцией почек;сердечной декомпенсации;повышенной секреции в кровь антидиуретического гормона гипоталамуса - гормона, способствующего задержке воды в организме.

Гипопротеинемия Абсолютная гипопротеинемия, как правило, связана с гипоальбуминемией. При этом уменьшение концентрации общего белка в сыворотке крови возникает при:недостаточном поступлении белка в организм (голодание, недоедание, сужение пищевода, нарушение функции желудочно-кишечного тракта, например, воспалительного характера — энтериты, энтероколиты и др.);подавлении биосинтеза белка, сопровождающем хронические воспалительные процессы в печени (гепатиты, циррозы печени, интоксикации, атрофия печени);врожденных нарушениях синтеза отдельных белков крови (анальбуминемия, болезнь Вильсона-Коновалова, другие дефектопротеинемии — значительно более редко);повышенном распаде белка в организме (злокачественные новообразования, обширные ожоги, гиперфункция щитовидной железы (тиреотоксикоз), состояния после операции, длительная лихорадка, травмы, длительное лечение кортикостероидами);повышенной потере белка (нефротический синдром, гломерулонефрит, сахарный диабет, длительный (хронический) понос, кровотечения);перемещении белка в «третьи» пространства (асцит, плеврит).

Другие причины изменения концентрации белков плазмы крови Уменьшение концентрации общего белка в сыворотке крови отмечается и при некоторых физиологических состояниях, например, при длительной физической нагрузке, у женщин в последние месяцы беременности и в период лактации.На уровень общего белка в сыворотке крови может оказывать влияние прием некоторых лекарственных препаратов. Так, например, кортикотропин, кортикостероиды, мисклерон, бромсульфалеин и клофибрат способствуют повышению концентрации общего белка в сыворотке, а пиразинамид, эстрогены — его снижению.На степень концентрации общего белка может оказывать влияние и положение тела: при изменении горизонтального положения тела на вертикальное концентрация общего белка повышается приблизительно на 10% в течение 30 минут.Пережатие сосудов во время взятия крови и «работа рукой» также могут привести к возрастанию концентрации общего белка в сыворотке крови.

Спасибо за внимание !