Презентация на тему: Алкины



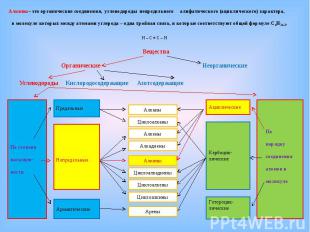
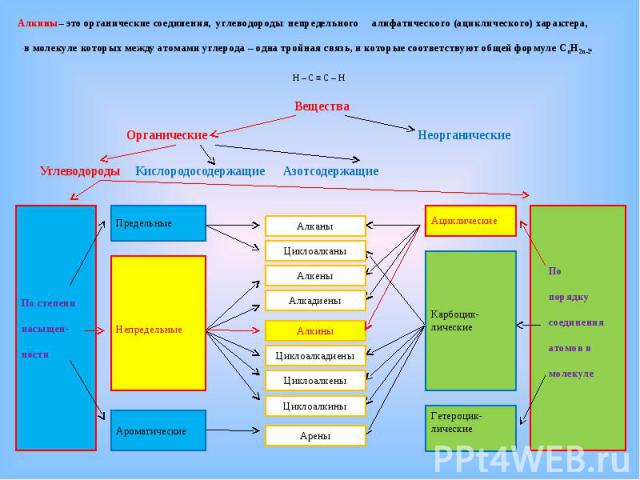
Вещества Вещества Органические Неорганические Углеводороды Кислородосодержащие Азотсодержащие

В названии алкинов содержится суффикс –ин, обозначающий принадлежность соединения к данному классу. В названии алкинов содержится суффикс –ин, обозначающий принадлежность соединения к данному классу. Простейший алкин: C2H2 или H – C ≡ C – H этин или ацетилен, В определении названия алкина по заместительной номенклатуре ИЮПАК положение кратной связи имеет при нумерации преимущество перед остальными. CH3 Cl CH3 | | | CH3 – CH – CH – C – C ≡ C – CH3 | C2H5 4,6-диметил-4-этил-5-хлоргептин-2 По радикально-функциональной номенклатуре в основе названия лежит название простейшего алкина (ацетилен), атомы водорода которого замещены на определенный углеводородный радикал: CH ≡ C – CH2 – CH2 – CH3 пропилацетилен

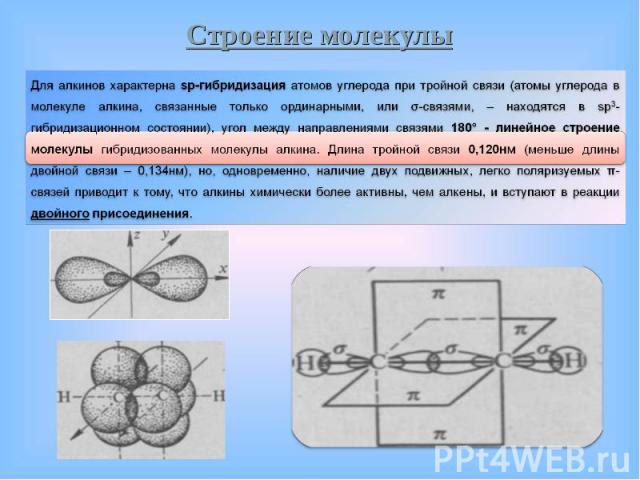
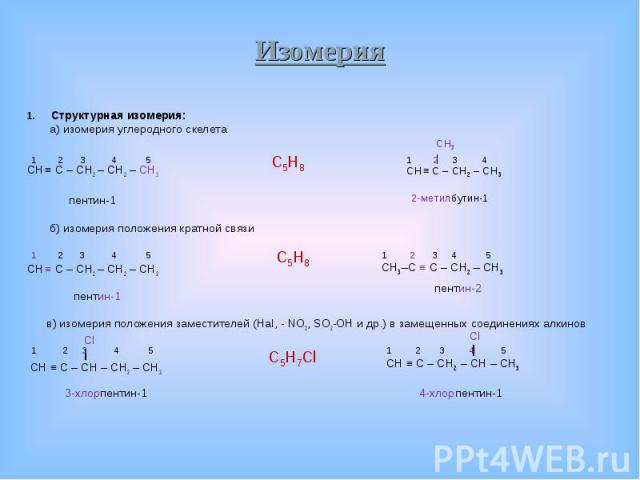
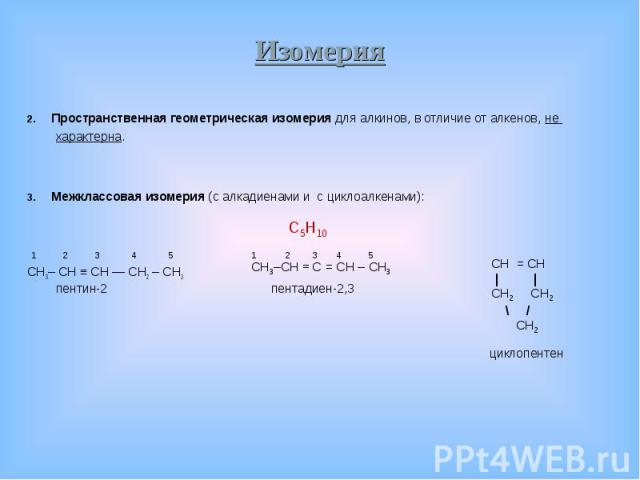
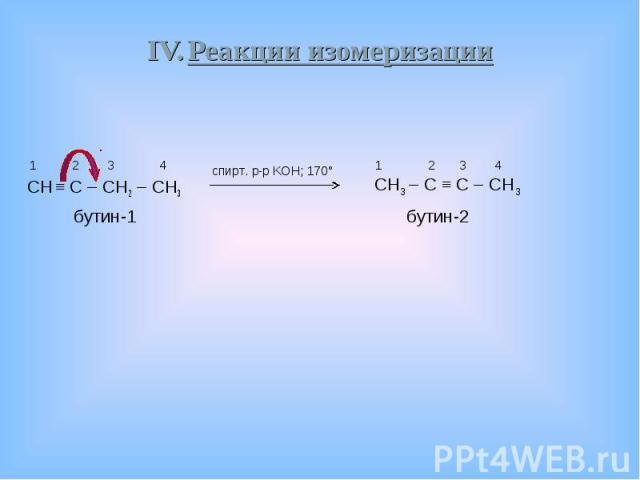
H H H H | | H – C – C ≡ C – C – H | | H H Для алкинов характерны следующие виды изомерии: Структурная изомерия: а) изомерия углеродного скелета б) изомерия положения кратной связи в) изомерия положения заместителей (Hal, - NO2, SO2-OH и др.) в замещенных соединениях алкенов Пространственная геометрическая изомерия для алкинов, в отличие от алкенов, не характерна. Межклассовая изомерия (с алкадиенами, с циклоалканами).
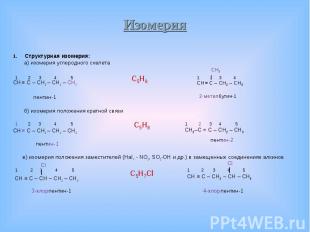
Структурная изомерия: Структурная изомерия: а) изомерия углеродного скелета CH ≡ C – CH2 – CH2 – CH3 пентин-1 б) изомерия положения кратной связи CH ≡ C – CH2 – CH2 – CH3 пентин-1 в) изомерия положения заместителей (Hal, - NO2, SO2-OH и др.) в замещенных соединениях алкинов Cl | CH ≡ C – CH – CH2 – CH3

Пространственная геометрическая изомерия для алкинов, в отличие от алкенов, не Пространственная геометрическая изомерия для алкинов, в отличие от алкенов, не характерна. Межклассовая изомерия (с алкадиенами и с циклоалкенами): CH3– CH ≡ CH ― CH2 – CH3

Их температуры плавления и кипения, также как у алканов и алкенов, закономерно повышаются при увеличении молекулярной массы соединения. Алкины плохо растворимы в воде, но лучше, чем алканы и алкены. Алкины имеют специфический запах.

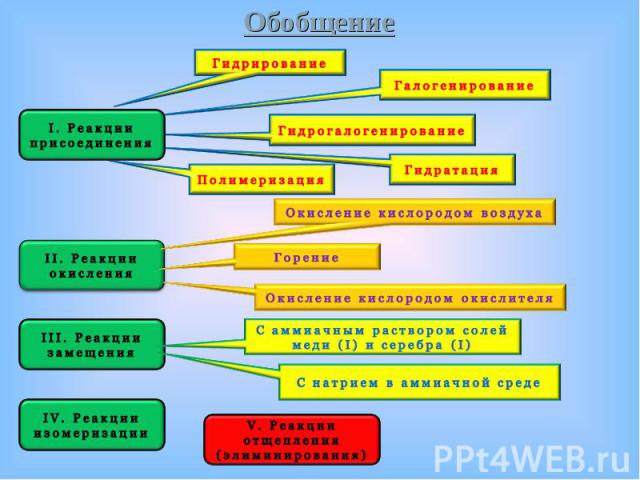
H – C ≡ C – H H – C ≡ C – H Реакции присоединения Реакции окисления Реакции замещения Реакции изомеризации Реакции элиминирования (отщепления)

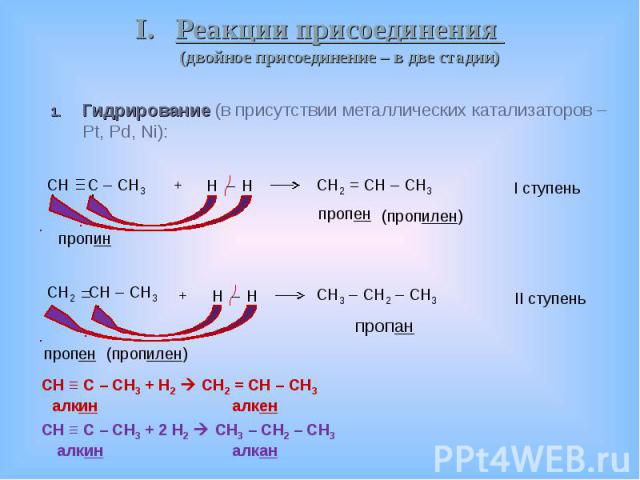
Гидрирование (в присутствии металлических катализаторов – Pt, Pd, Ni): Гидрирование (в присутствии металлических катализаторов – Pt, Pd, Ni):
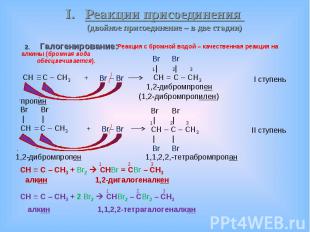
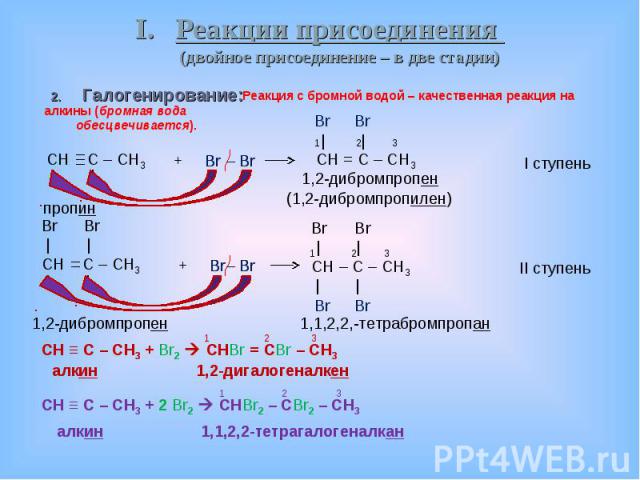
Галогенирование: Галогенирование:
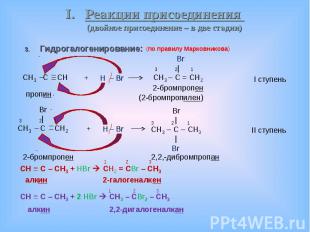
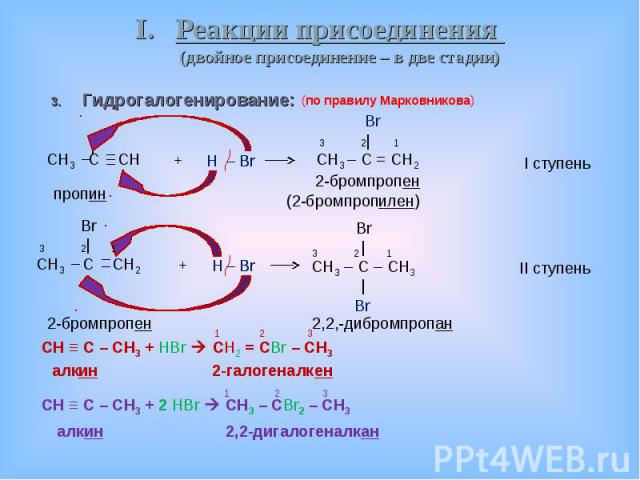
Гидрогалогенирование: Гидрогалогенирование:
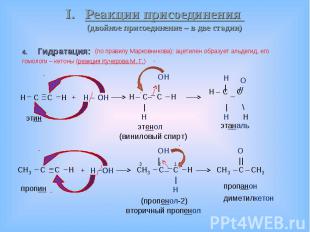
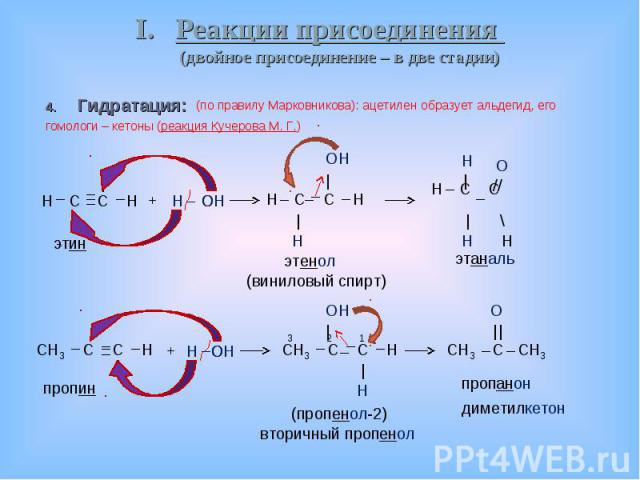
Гидратация: Гидратация:

Реакции полимеризации. Реакции полимеризации. а) полимеризация I стадия – линейная

Реакции полимеризации. Реакции полимеризации. а) полимеризация II стадия – объёмная
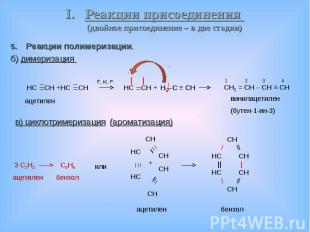
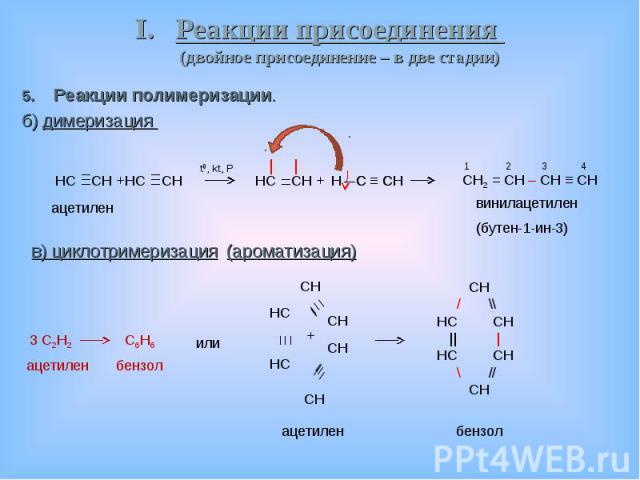
Реакции полимеризации. Реакции полимеризации. б) димеризация

Горение Горение 2C2H2 + 5 O2 (избыток) 2C2H2 + 3 O2 (недостаток) 2C2H2 + O2 (сильный недостаток) Смеси ацетилена с воздухом или кислородом взрывоопасны; ацетилен может также взрываться при ударах.

Неполное окисление кислородом окислителя (KMnO4 в нейтральной среде, Неполное окисление кислородом окислителя (KMnO4 в нейтральной среде, K2Cr2O7 в кислой среде) – конечным продуктом реакции являются карбоновые кислоты. (обесцвечивание раствора KMnO4 – это качественная реакция на непредельные углеводороды: алкины обесцвечиваются быстрее, чем алкены)

Из дизамещенных гомологов ацетилена при окислении образуются соответствующие Из дизамещенных гомологов ацетилена при окислении образуются соответствующие

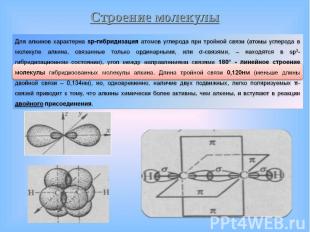
Атомы водорода, связанные с sp-гибридизованными атомами Атомы водорода, связанные с sp-гибридизованными атомами углерода в молекулах алкинов, обладают значительной подвижностью (что объясняется поляризацией связи ≡C–H), поэтому они могут замещаться атомами металлов – в результате чего образуются ацетилениды. Способность к таким реакциям отличает алкины от других непредельных углеводородов.

Взаимодействие с металлическим натрием в жидком аммиаке Взаимодействие с металлическим натрием в жидком аммиаке

Взаимодействие с аммиачными растворами солей меди (I) – Взаимодействие с аммиачными растворами солей меди (I) – только монозамещенные ацетилена

Взаимодействие с аммиачным раствором оксида серебра (I) – Взаимодействие с аммиачным раствором оксида серебра (I) – только монозамещенные ацетилена
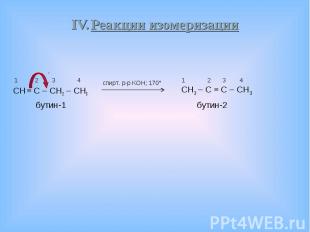
CH ≡ C – CH2 – CH3

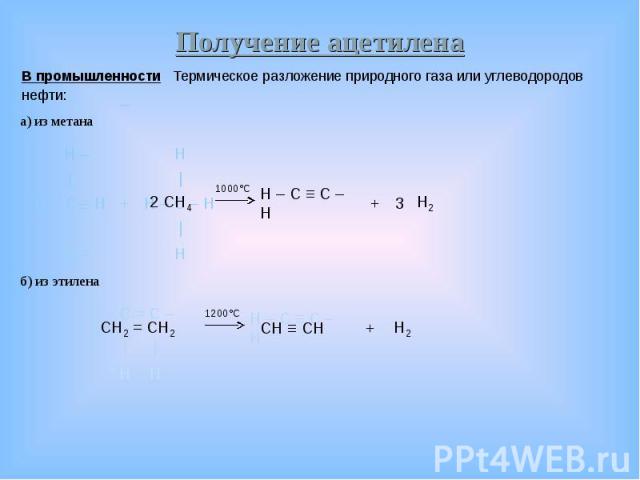
В промышленности Термическое разложение природного газа или углеводородов В промышленности Термическое разложение природного газа или углеводородов нефти:

В лаборатории Гидролиз карбида кальция (реакция Велера Ф.) или В лаборатории Гидролиз карбида кальция (реакция Велера Ф.) или карбидов других активных металлом (K, Mg)

Дегидрогалогенирование дигалогеналканов действием спиртового раствора Дегидрогалогенирование дигалогеналканов действием спиртового раствора щелочи или твердой щелочи при нагревании (по правилу Зайцева): при отщеплении галогенводорода от вторичных и третичных галогеналканов атом водорода отщепляется от наименее гидрированного атома углерода.
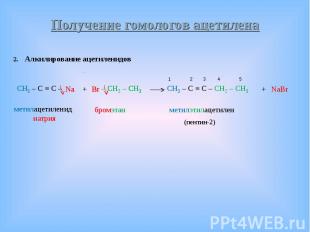
Алкилирование ацетиленидов Алкилирование ацетиленидов