Презентация на тему: Алюминий. Сплавы алюминия

Алюминий. Сплавы алюминия Учитель: Белозерова Татьяна Анатольевна Ученица: Манжура Виктория Владимировна
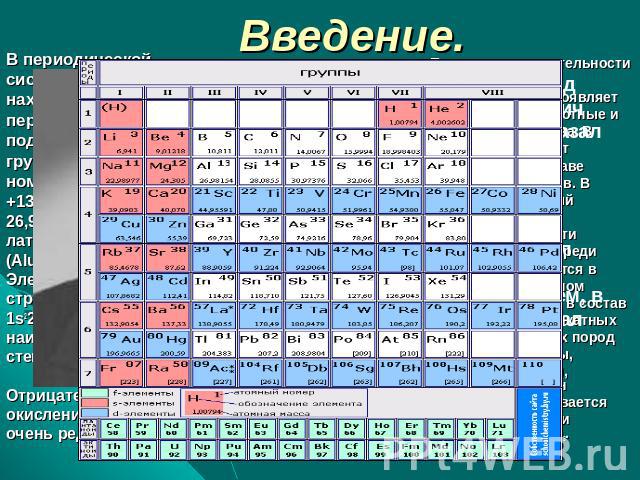
Введение. В периодическойсистеме алюминийнаходится в третьемпериоде, в главнойподгруппе третьейгруппы, его атомныйномер13, заряд ядра+13,атомная масса26,9815.Обозначаетсялатинскими буквами AL(Aluminium). Электронноестроение атома1s22s22p63s23p1,наиболее характернаястепени окисления +3 и 0.Отрицательные степениокисления проявляютсяочень редко.

Историческая справка. В 1930 г. Мироваявыплавка этого металласоставила 300 тыс. т. В 1975 получено около 10 млн. т алюминия с 1855 по 1890 г., способом Сент-Клер Девиля было получено 200 т металлического алюминия. В 1825 г. алюминий стоил в 1500 раз дороже железа, в наши дни – лишь втрое. Сегодня алюминий дороже простой углеродистой стали, но дешевле нержавеющей.

Нахождение в природе. В свободном виде алюминия в природе нет! Но алюминий находится практически везде на земном шаре, так как его оксид (Al2O3) составляет основу глинозема. И хотя содержание его в земной коре 8,8% (для сравнения, например, железа в земной коре 4,65% - в два раза меньше), а по распространенности занимает третье место после кислорода (O) и кремния (Si). Алюминий в природе встречается в соединениях – его основные минералы: боксит - смесь минералов диаспора, бемита AlOOH, гидраргиллита Al(OH)3 и оксидов других металлов - алюминиевая руда 5. полевой шпат (ортоклаз) - K2O * Al2O3 * 6SiO2 ; каолинит - Al2O3 * 2SiO2 * 2H2O - важнейшая составляющая часть глины и другие алюмосиликаты, входящие в состав глин.

Физические свойства. Серебристо-белый, довольно твердый металл, блестящий,пластичный, легко вытягивается в проволоку и прокатывается втонкие листы (фольгу, до 0,005мм). Электропроводность алюминиядовольно высока и уступает только серебру (Ag) и меди (Cu) (в 2,3раза больше чем у меди) , так же алюминий теплопроводен. На воздухе покрывается тончайшей (0,00001мм), но оченьплотной матовой защитной пленкой оксида Аl2О3, весьмаустойчивой, предохраняющей металл от дальнейшего окисления ипридающий ему матовый вид. При обработке поверхностиалюминия сильными окислителями (конц.HNO3,K2Cr2O7) илианодным окислением толщина защитной пленки возрастает.Устойчивость алюминия позволяет изготавливать из негохимическую аппаратуру и емкости для хранения итранспортировки азотной кислоты.Физические константы: М, = 26,982 »27, р = 2,70 г/см3 t пл. =660,37 °С, tкип=2500°С ФизическимиСвойствами(явлениями)Называютсятакие, прикоторых могутизменитьсяразмеры, формател илиагрегатноесостояниевеществ, носостав ихостаетсяпостоянным.

Химические свойства I.Взаимодействие алюминия с простыми веществами. 1. При комнатной температуре алюминий легко соединяется с кислородом, при этом на поверхности алюминия образуется оксидная пленка (слой Аl2O3). 4Al + 3O2 = 2Al2O3 2. Взаимодействие с галогенами:2Al + 3Cl2 = 2AlCl3 Хлорид алюминия2Al + 3Br2 = 2AlBr3 Бромид алюминия 3. Взаимодействие с серой:2Al + 3S=t° 2Al2S3 Сульфид алюминия 4. Взаимодействие с азотом:2Al + N2=t° 2AlN Нитрид алюминия 5. Взаимодействие с углеродом:4Al + 3C =t° Al4C3 Карбид алюминия Явления, врезультатекоторых изодноговеществаобразуютсядругие,называютсяхимическимиявлениями(свойствами)илихимическимиреакциями.

II.Взаимодействие алюминия со сложными веществами. 1.Если удалить оксидную пленку он активно взаимодействует с водой: 2Al + 6H2O = 2Al(OH)3 + 3H2 ↑ 2. Алюминий реагирует с оксидами металлов: 2Al + Fe2O3 =t° 2 Fe + Al2O3 3. Взаимодействие с разбавленными кислотами (HCl, H2SO4): б) 2Al + 3H2SO4 = Al2(SO4)3 +3H2 ↑ 4. Взаимодействует с концентратной серной кислотой:8Al + 15 H2SO4 =t° 4Al2(SO4)3 + 3H2S↑ + 12H2O 5. С концентрированной азотной кислотой алюминий не реагирует. С разбавленной азотной кислотой алюминий реагирует:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O 6. Взаимодействие алюминия со щелочами:Al2O3 + 2NaOH = 2NaAlO2 + H2O

Оксид алюминия Al2O3 Белый аморфный порошок или очень твердые белые кристаллы. Физические константы: Мr = 101,96~102, р = 3,97 г/см3 tпл=2053°С, tкип=3000°СКристаллический Аl2О3 химически пассивен, аморфный — более активен.Медленно реагирует с кислотами и щелочами в растворе, проявляяамфотерные свойства:Al2O3 + 6НСl(конц.) = 2АlСl3 + ЗН2О Al2O3 + 2NаОН(конц.) + ЗН2О = 2Na[Al(OH)4](в расплаве щелочи образуется NaAlO2). Вторая реакцияиспользуется для «вскрытия» бокситов.Помимо сырья для производства алюминия, Аl2О3 в виде порошкаслужит компонентом огнеупорных, химически стойких и абразивныхматериалов. В виде кристаллов применяется для изготовлениялазеров и синтетических драгоценных камней ( рубины, сапфиры идр.), окрашенных примесями оксидов других металлов — Сr2О3(красный цвет), Тi2О3 и Fe2О3 (голубой цвет). Оксиды- это сложные вещества, состоящие из двух элементов, один из которых -кислород со степенью окисления -2

Гидроксид алюминия. Физические константы: Мr=78,00 р= 3,97 г/см3, t разл > 170 °СПри нагревании ступенчато разлагается, образуя промежуточный продукт — метагидроксид AlO(OH):Проявляет амфотерные, равно выраженные кислотные и основные свойства: 1.Взаимодействие гидроксида алюминия с кислотами: Al(OH)3 + 3HCl = AlCl3 + 3H2O 2.Взаимодействие Al(OH)3 со щелочами: Al(OH)3+ NaOH = NaAlO2 + 2H2O Удобный способ получения Аl(ОН)3 — пропускание СО2 через раствор гидроксокомплекса:[Аl(ОН)4]- + СО2 = Аl(ОН)3+ НСО3-

Сплавы алюминия. Силумины - сплавы на основе алюминия с большим содержанием кремния (Si). В состав силуминов входят: 3-26% Si ,1-4% Cu ,0,2-1,3% Mg ,0,2-0,9% Mn ,иногда 2-4% Zn , 0,8-2% Ni , 0,1-0,4% Cr , 0,05-0,3% Ti и др.Силумины обладают наилучшими из всех алюминиевых сплавов литейными свойствами. Они наиболее часто используются там, где необходимо изготовить тонкостенные или сложные по форме детали.Нашли свое основное применение в: авиастроении;вагоностроении;автомобилестроении и строительстве сельскохозяйственных машин для изготовления картеров, деталей колес, корпусов и деталей приборов. САП - сплавы, состоящие из Al и 20-22% Al2O3 . Получают спеканием окисленного алюминиевогопорошка. Послеспекания частицы Al2O3 играют роль упрочнителя. Прочность данного соединения при комнатной температуре ниже, чем у дуралюминов и магналиев, но при температуре превышающей 200 °С превосходит их. При этом САП обладают повышенной стойкостью к окислению,поэтому они незаменимы там, где температура эксплуатации превышает 400 °С .

Применение. Из алюминия и его сплавов изготовляют авиоконструкции, моторы, блоки, головки цилиндров, картеры, коробки передач, насосы и другие детали. Алюминием и его сплавами отделывают железнодорожные вагоны, изготовляют корпуса и дымовые трубы судов, спасательные лодки, радарные мачты, трапы. Широко применяют алюминий и его сплавы в электротехнической промышленности для изготовления кабелей, шинопроводов, конденсаторов, выпрямителей переменного тока. Алюминий обладает целым рядом свойств, которые выгодно отличают егоот других металлов. Широкое применение получил так называемый термит - смесь оксида железа Fe3O4 с алюминием. 8Al + 3Fe3O4 = 4Al2O3 + 9Fe Данный процесс используют при сварке. Иногда для получения некоторых чистых металлов в свободном виде. В технике алюминий используют для насыщения поверхности стальных и чугунных изделий с целью защиты этих изделий от коррозии.Гидрооксид алюминия Al(OH)3 используется для крашения тканей, для изготовления керамики и как нейтрализующий агент. Алюминиевая фольга используется как упаковочный материал для продуктов питания (например шоколада), более толстая - для изготовления банок для напитков.Некоторые соли алюминия применяются в медицине для лечения кожных заболеваний: KAl(SO4)2 · 12 H2O- алюмокалиевые квасцы: (СН3СОО)3Al – ацетат алюминия. Хлорид алюминия AlCl3 применяется в качестве катализатора в органической химии. Сульфат алюминия Al2(SO4) 3 · 18 H2O используется для очистки воды.

Тест 5. Какие из указанных металлов являются более активными, чем алюминий? А.Na Б. Cu B.Сa Г. Fe6.Растворы каких веществ имеют щелочную реакцию среды (pH>7)? А.AlCl3 Б. Al(NO3) 3 B.NaAlO2 Г. Al2 (SO4) 37.В чем растворяется Al2O3 ? А. H2O Б. Раствор NaOH B. раствор HCl Г. Раствор NaCl Вариант I.1.Какова электронная конфигурация атома алюминия? А. 1s22s22p1 Б. 1s22s22p3 B. 1s22s22p63s23p1 Г. 1s22s22p63s23p63d14s22.С каким из указанных веществ реагирует алюминий? А.CaO Б.HCl B.Cl2 Г. NaOH3.С каким из указанных веществ реагирует гидроксид алюминия? А.N2 Б. NaOH B.H2SO4 Г. H2O4.Какие вещества образуются при взаимодействии Al(OH)3 и NaOH? А.Na2O Б. Al2O3 B.NaAlO2 Г. H2O

Вариант II.1.Какова электронная конфигурация иона Al+3? А. 1s2 Б. 1s22s22p6 B. 1s22s22p63s23p6 Г. 1s22s22p63s23p12.С каким из указанных веществ реагирует оксид алюминия ? А. H2O Б.N2 B. NaOH Г. H2SO4 3.С каким из указанных веществ реагирует алюминий? А. SO2 Б.Br2 B. NaCl Г. KOH 4. Какие вещества образуются при взаимодействии Al2O3 с KOH ? А. Al(OH) 3 Б.K2O B. H2O Г. KAlO2 5. Какие из указанных металлов являются менее активными, чем алюминий? А. Ag Б.Ba B. Hg Г. K 6. Растворы каких веществ имеют кислую реакцию среды (pH<7)? А. KAlO2 Б.Al2 (SO4) 3 B. K3AlO3 Г. Al(NO3) 3 7. В чем растворяется Al(OH) 3? А. раствор NaOH Б. H2O B. растворKCl Г. Раствор H2SO4