Презентация на тему: ПРОТИВООПУХОЛЕВЫЙ ИММУНИТЕТ


О пухоль (син.: новообразование, неоплазия, неоплазма) — патологический процесс, представленный новообразованной тканью, в которой изменения генетического аппарата клеток приводят к нарушению регуляции их роста и дифферанцировки. Все опухоли подразделяют в зависимости от их потенций к прогрессии и клинико-морфологических особенностей на две основные группы: доброкачественные опухоли, злокачественные опухоли.

Доброкачественные (зрелые, гомологичные) опухоли состоят из клеток, дифференцированных в такой мере, что можно определить, из какой ткани они растут. Для этих опухолей характерен медленный экспансивный рост, отсутствие метастазов, отсутствие общего влияния на организм. Доброкачественные опухоли могут малигнизироваться. Доброкачественные (зрелые, гомологичные) опухоли состоят из клеток, дифференцированных в такой мере, что можно определить, из какой ткани они растут. Для этих опухолей характерен медленный экспансивный рост, отсутствие метастазов, отсутствие общего влияния на организм. Доброкачественные опухоли могут малигнизироваться. Злокачественные (незрелые, гетерологичные) опухоли состоят из умеренно- и малодифференцированных клеток. Они могут утратить сходство с тканью, из которой они исходят. Для злокачественных опухолей характерен быстрый, чаще инфильтрирующий рост, метастазирование и рецидивирование, наличие общего влияния на организм. Для злокачественных опухолей характерен как клеточный, так и тканевой атипизм.

Нобелевский лауреат Пауль Эрлих высказал предположение, что иммунная система способна защитить организм от опухолей. Развивая эту идею, Фрэнк Бёрнет выдвинул гипотезу иммунологического надзора по отношению к опухолям. Эта гипотеза несколько десятилетий не получала ни подтверждения, ни опровержения. Относительно недавно Олд и Шрайбер показали, что организмы с иммунологической недостаточностью, в большей степени подвержены риску развития опухолей. Нобелевский лауреат Пауль Эрлих высказал предположение, что иммунная система способна защитить организм от опухолей. Развивая эту идею, Фрэнк Бёрнет выдвинул гипотезу иммунологического надзора по отношению к опухолям. Эта гипотеза несколько десятилетий не получала ни подтверждения, ни опровержения. Относительно недавно Олд и Шрайбер показали, что организмы с иммунологической недостаточностью, в большей степени подвержены риску развития опухолей. Важным научным достижением явилось понимание того, что опухолевые клетки могут индуцировать иммунитет. Введенные в здоровый организм, они являются вакциной – но только против той самой опухоли, из которой они были выделены. Протективный (защищающий) иммунитет развивается только после профилактической иммунизации (до возникновения опухоли, и такая иммунизация пока возможна только в условиях эксперимента, когда здоровому животному пересаживают злокачественную опухоль от больного); если иммунизировать после возникновения опухоли (терапевтическая вакцинация), используя клетки, полученные из этой же опухоли, воспрепятствовать ее дальнейшему росту не удастся.


Протеины Протеины Гликолипиды (экспрессируются на поверхности опухолевых клеток ) Полисахариды Гликопротеины

Опухолеспецифические АГ (трансплантационные АГ) - присутствуют только на опухолевых клетках. Имеют вирусное происхождение. Опухолеассоциированные АГ – - гетероорганные АГ (нельзя отнести к чужеродным, т.к они присутствуют также в каких-либо нормальных тканях) - типичные АГ для нормальной ткани - АГ с упрощенным строением

Опухолеассоциированные антигены первого типа (T-антигены) имеют вирусное происхождение и обнаруживаются на клетках опухолей, индуцированных ДНК- или РНК-содержащими вирусами. Опухолеассоциированные антигены первого типа (T-антигены) имеют вирусное происхождение и обнаруживаются на клетках опухолей, индуцированных ДНК- или РНК-содержащими вирусами. Мелкие ДНК-содержащие вирус полиомы, вирус SV40 и вирус папилломы (вирус папилломы ассоциирован с раком шейки матки у человека) кодируют T-антигены, свойственные и другим вирусам той же группы. Данные антигены представляют собой ядерные белки, играющие определенную роль в поддержании трансформированного состояния. РНК-содержащие инфекционные онкогенные вирусы вызывают лейкозы и саркомы у животных; у человека обнаружен по крайней один РНК-содержащий вирус T-клеточного лейкоза. Общие антигены ДНК- и РНК-содержащих вирусов вызывают сильные гуморальный и клеточный ответы, способные обеспечить защиту против опухоли.

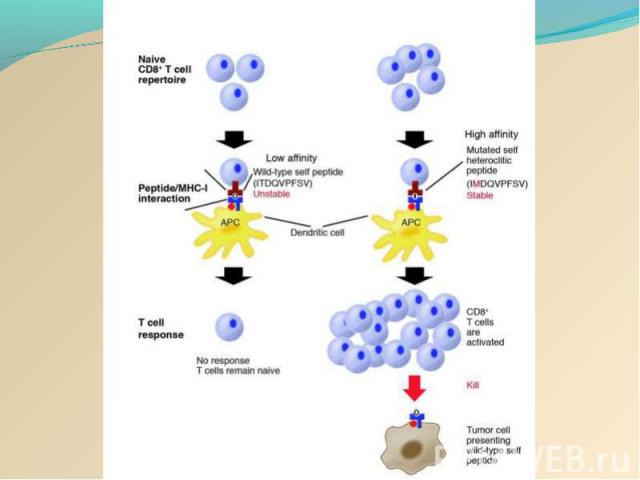
Опухолеассоциированные антигены второго типа (специфические опухолевые антигены, опухолеспецифические трансплантационные антигены) могут вызвать иммунный ответ на введенные опухолевые клетки в том случае, если животное было предварительно иммунизировано материалом той же опухоли. При иммунизации у генетически идентичных мышей образовывались цитотоксические T-клетки , способные уничтожать имплантат только того клона, который был использован для иммунизации. Эти цитотоксические T-клетки затем использовались в качестве зондов для определения опухолевого антигена при молекулярном клонировании соответствующего гена. При секвенировании этого гена было показано, что появление иммуногенности у антигена определяется изменением всего одного аминокислотного остатка. Учитывая, что распознавание антигенов цитотоксическим T-клетками рестриктировано по молекулам MHC класса I , можно предположить, что опухолеспецифический белок процессируется в опухолевой клетке с образованием пептида, который затем образует комплекс с молекулами MHC класса I и транспортируется на клеточную поверхность. Опухолеассоциированные антигены второго типа (специфические опухолевые антигены, опухолеспецифические трансплантационные антигены) могут вызвать иммунный ответ на введенные опухолевые клетки в том случае, если животное было предварительно иммунизировано материалом той же опухоли. При иммунизации у генетически идентичных мышей образовывались цитотоксические T-клетки , способные уничтожать имплантат только того клона, который был использован для иммунизации. Эти цитотоксические T-клетки затем использовались в качестве зондов для определения опухолевого антигена при молекулярном клонировании соответствующего гена. При секвенировании этого гена было показано, что появление иммуногенности у антигена определяется изменением всего одного аминокислотного остатка. Учитывая, что распознавание антигенов цитотоксическим T-клетками рестриктировано по молекулам MHC класса I , можно предположить, что опухолеспецифический белок процессируется в опухолевой клетке с образованием пептида, который затем образует комплекс с молекулами MHC класса I и транспортируется на клеточную поверхность. Экспериментально показана также возможность сверхэкспрессии опухолеассоциированных антигенов второго типа. Получены убедительные доказательства в пользу существования иммунного ответа, рестриктированного по антигенам MHC класса II , по крайней мере на опухоли человека, однако значительно меньше известно о том, какие опухолевые антигены распознаются в комплексе с молекулами MHC класса II .

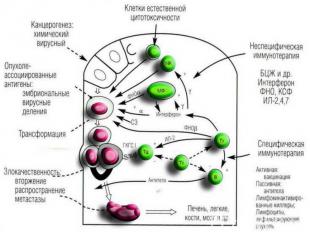
Клинические и экспериментальные наблюдения указывали на повышенную частоту возникновения многих типов опухолей для больных с иммуносупрессией: Клинические и экспериментальные наблюдения указывали на повышенную частоту возникновения многих типов опухолей для больных с иммуносупрессией: 1) вероятность возникновения опухолей у иммунодефицитных детей в 10000 раз выше, чем у здоровых; 2) тимэктомия или врожденное отсутствие тимуса , как, например, у мышей линии nude, приводят к увеличению частоты спонтанных опухолей или к большей легкости канцерогенной индукции новообразований; 3) применение иммунодепрессивной терапии способствует возникновению неопластического роста 4) наличие у опухолевых клеток специфических антигенов определяет развитие иммунного ответа, главным образом, Т-клеточного типа.

Гуморальные ( с появлением АТ) Клеточные АТ + АГопухолевых клеток

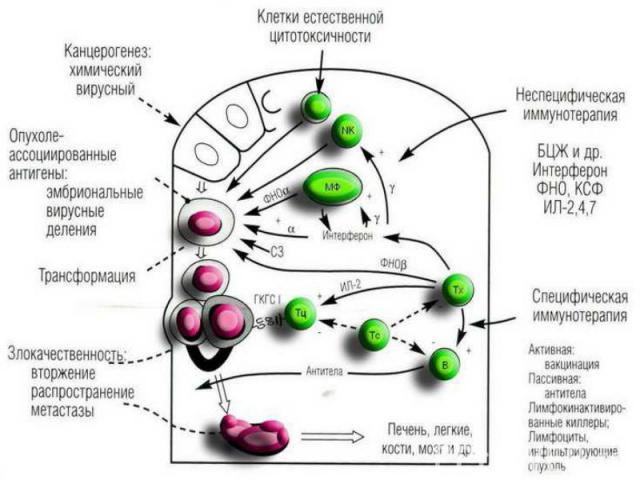
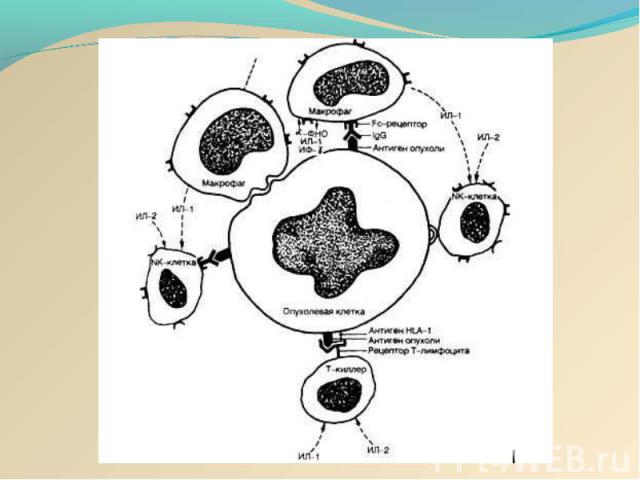
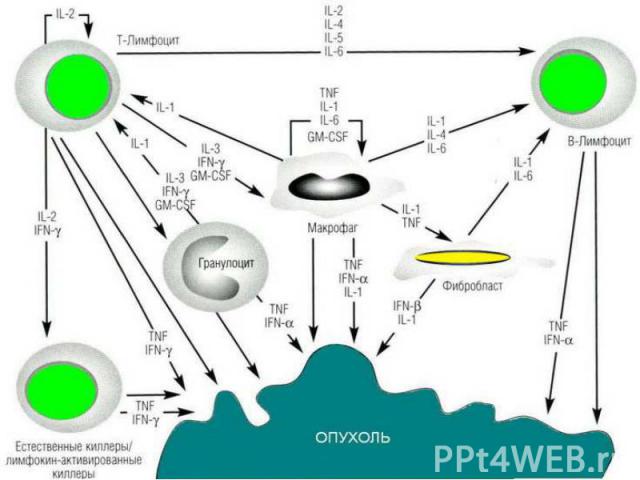
Противоопухолевые иммунные факторы: I. Клеточные: 1) Т-лимфоциты-киллеры; 2) ЕК- и К-клетки; 3) активированные макрофаги; 4) гранулоциты. II. Гуморальные: 1) специфические антитела; 2) интерлейкины-1 и 2; 3) фактор некроза опухолей (ФНО); 4) интерфероны. Противоопухолевые иммунные факторы: I. Клеточные: 1) Т-лимфоциты-киллеры; 2) ЕК- и К-клетки; 3) активированные макрофаги; 4) гранулоциты. II. Гуморальные: 1) специфические антитела; 2) интерлейкины-1 и 2; 3) фактор некроза опухолей (ФНО); 4) интерфероны.
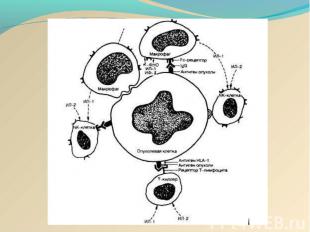
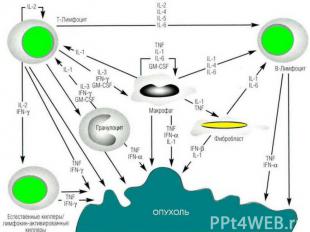

Развивающаяся опухоль постоянно ускользает от иммунного надзора за счет факторов иммунорезистентности опухоли. Иммунорезистентность опухоли обеспечивается: Развивающаяся опухоль постоянно ускользает от иммунного надзора за счет факторов иммунорезистентности опухоли. Иммунорезистентность опухоли обеспечивается: 1) слабой иммунногенностью опухолевых антигенов; 2) постоянной модификацией антигенов опухоли; 3) селекцией иммунологически устойчивых клеток; 4) потерей экспрессии антигенов системы HLA класса I; 5) выделением растворимых опухолевых антигенов; 6) экспрессией на поверхности опухолевых клеток и выбросом в межклеточное пространство рецепторов к различным цитокинам; 7) приобретением устойчивости к запрограммированной клеточной гибели за счет: потери рецептора к ФНО, появления на мембране молекулы FasL; 8) продукцией опухолевыми клетками ИЛ-6, ИЛ-10, ФНО и т.д.

Более того, на определенном этапе развития опухоли иммунная система хозяина начинает выделять пробластомные (способствующие росту опухоли) факторы, которые: а) подавляют иммунитет; б) способствуют усилению роста опухоли. Пробластомные факторы, подавляющие иммунитет: 1. Супрессивные вещества, продуцируемые лимфоцитами и макрофагами. 2. Блокирующие антитела. 3. Циркулирующие иммунные комплексы. 4. Простагландины ПГЕ2. 5. Интерлейкин-10. 6. Трансформирующий фактор роста бета (TGFbeta), подавляющий: а) продукцию цитокинов (ИЛ-12); б) созревание Т-киллеров; в) экспрессию рецепторов к цитокинам. Пробластомные факторы, усиливающие рост опухоли: 1. Фактор роста опухоли, продуцируемый макрофагами. 2. Интерлейкины-2 и 6. 3. Гамма-интерферон. 4. Фактор роста сосудистого эндотелия. 5. Иммунодефицитное состояние: а) нарушение созревания Т-киллеров; б) нарушение функции антиген-представляющих клеток.

Опухолевые клетки не экспрессируют антигены тканевой совместимости 1-го класса, необходимые для распознавания их цитотоксическими CD8 Т-лимфоцитами. Известный феномен «ускользания» (escape) состоит в постоянной мутации опухолевых антигенов, когда в результате отбора сохраняются только те опухолевые клетки, которые способны меняться постоянно с большой скоростью, опережая реакции системы иммунитета. Генетическая нестабильность опухолевых клеток, их гетерогенность обеспечивают раку чрезвычайную жизнестойкость. Опухолевые клетки не экспрессируют антигены тканевой совместимости 1-го класса, необходимые для распознавания их цитотоксическими CD8 Т-лимфоцитами. Известный феномен «ускользания» (escape) состоит в постоянной мутации опухолевых антигенов, когда в результате отбора сохраняются только те опухолевые клетки, которые способны меняться постоянно с большой скоростью, опережая реакции системы иммунитета. Генетическая нестабильность опухолевых клеток, их гетерогенность обеспечивают раку чрезвычайную жизнестойкость.

Кроме того, к феномену «ускользания» относят: • маскировку опухолевых антигенов избытком антител или иммунных комплексов, вырабатываемых иммунной системой хозяина опухоли; • снижение или полную блокаду Т-киллеров антителами иммунной системы хозяина опухоли к противоопухолевым антигенам; • снижение «уровня презентации» опухолевых антигенов макрофагами, приводящее к угнетению продукции противоопухолевых цитокинов (ФНО, интерфероны и т.д.) макрофагами. Кроме того, к феномену «ускользания» относят: • маскировку опухолевых антигенов избытком антител или иммунных комплексов, вырабатываемых иммунной системой хозяина опухоли; • снижение или полную блокаду Т-киллеров антителами иммунной системы хозяина опухоли к противоопухолевым антигенам; • снижение «уровня презентации» опухолевых антигенов макрофагами, приводящее к угнетению продукции противоопухолевых цитокинов (ФНО, интерфероны и т.д.) макрофагами.

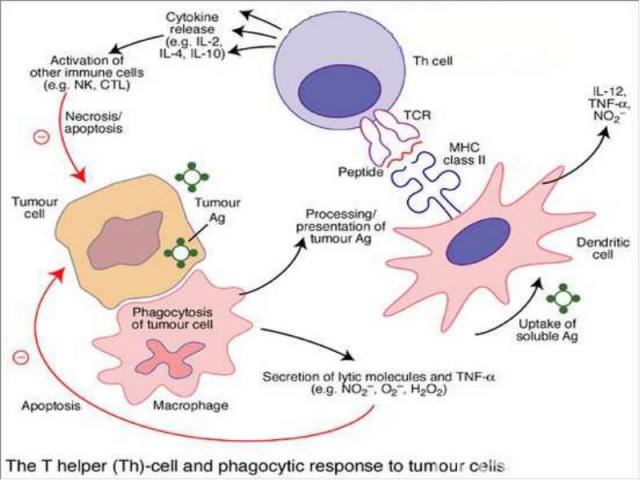
В смешанных культурах лимфоцитов и опухолевых клеток (СКЛОК) возможна стимуляция хелперных CD4 T-клеток и цитотоксических CD8 T-клеток . Если цитотоксические CD8 T-клетки выполняют прямую киллерную функцию, то ее успешной реализации способствуют T-хелперы, секретирующие цитокины. Среди них наибольшую роль играет IFγ, который стимулирует также макрофаги и увеличивает активность NK . В смешанных культурах лимфоцитов и опухолевых клеток (СКЛОК) возможна стимуляция хелперных CD4 T-клеток и цитотоксических CD8 T-клеток . Если цитотоксические CD8 T-клетки выполняют прямую киллерную функцию, то ее успешной реализации способствуют T-хелперы, секретирующие цитокины. Среди них наибольшую роль играет IFγ, который стимулирует также макрофаги и увеличивает активность NK . Опухолеспецифичные Т-клетки обнаруживаются у больных с различными типами опухолей. Особой иммуногенностью, по-видимому, обладает меланома: выявлено несколько антигенов, ассоциированных с меланомой, которые служат мишенями для цитотоксических T-клеток. Определены также отвечающие на антигены специфически, но не рестриктированно T-клетки от больных раком молочной железы и яичников. Какое значение имеют in vivo эти цитотоксические ответные реакции остается неясным, но в модельных экспериментах на животных эти клетки могут вызывать регрессию опухолей.
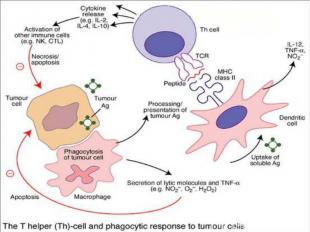
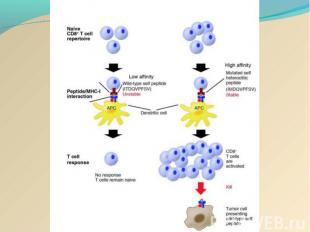
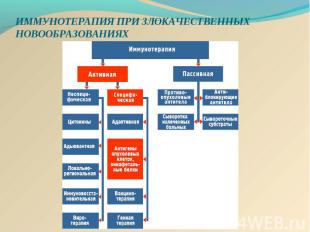
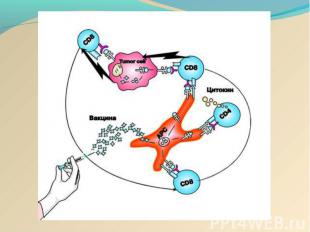
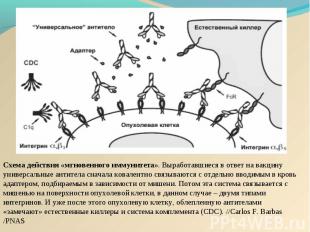
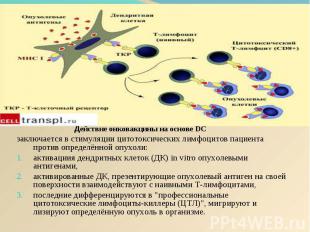
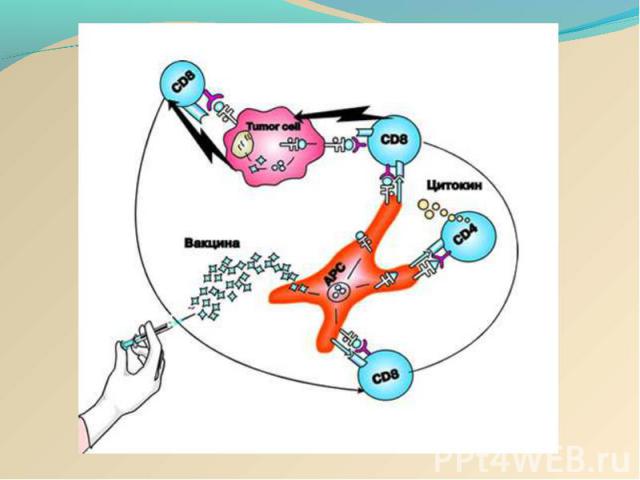
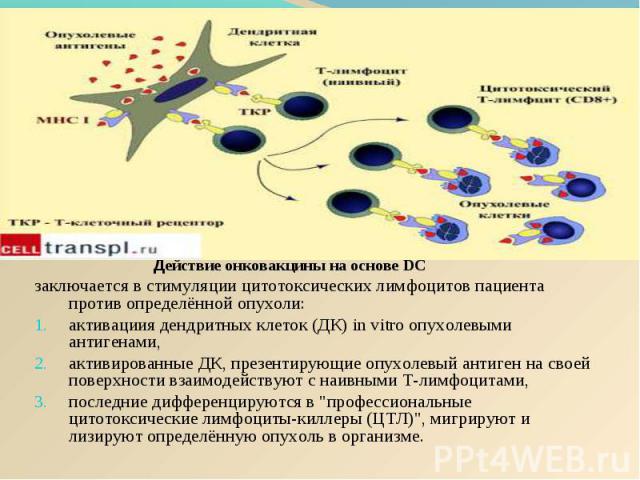
Действие онковакцины на основе DC Действие онковакцины на основе DC заключается в стимуляции цитотоксических лимфоцитов пациента против определённой опухоли: активациия дендритных клеток (ДК) in vitro опухолевыми антигенами, активированные ДК, презентирующие опухолевый антиген на своей поверхности взаимодействуют с наивными Т-лимфоцитами, последние дифференцируются в "профессиональные цитотоксические лимфоциты-киллеры (ЦТЛ)", мигрируют и лизируют определённую опухоль в организме.