Презентация на тему: Бета-лактамиды (природные и полусинтетические пенициллины и цефалоспорины)

Бета-лактамиды (природные и полусинтетические пенициллины и цефалоспорины) Бета-лактамиды (природные и полусинтетические пенициллины и цефалоспорины)

Изучить физико-химические и фармакологические свойства, методы оценки качества лекарственных средств указанной группы во взаимосвязи со структурой. Изучить физико-химические и фармакологические свойства, методы оценки качества лекарственных средств указанной группы во взаимосвязи со структурой.

План излагаемой лекции соответствует всем разделам фармакопейной статьи. План излагаемой лекции соответствует всем разделам фармакопейной статьи.
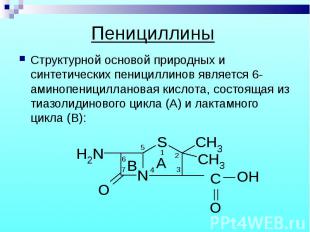
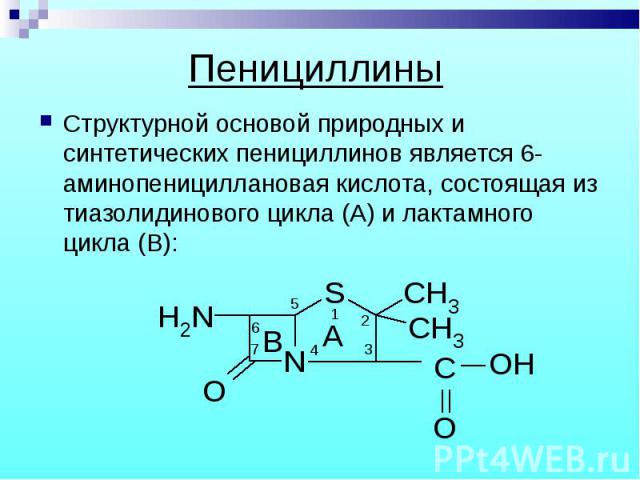
Структурной основой природных и синтетических пенициллинов является 6-аминопенициллановая кислота, состоящая из тиазолидинового цикла (А) и лактамного цикла (В): Структурной основой природных и синтетических пенициллинов является 6-аминопенициллановая кислота, состоящая из тиазолидинового цикла (А) и лактамного цикла (В):

Специфическая биологическая активность обусловлена наличием тиазолидинового и лактамного колец, а также заместителем в 6-ом положении. Специфическая биологическая активность обусловлена наличием тиазолидинового и лактамного колец, а также заместителем в 6-ом положении. Биосинтез природных пенициллинов осуществляется отобранными промышленными штаммами плесени, инкубированными в питательной среде, содержащей аминокислоты, углеводы, жиры и обязательно предшественников для формирования радикала в 6-ом положении.

Для выделения и очистки пенициллинов используют хроматографию, ионообменную сорбцию. Для выделения и очистки пенициллинов используют хроматографию, ионообменную сорбцию. Природные пенициллины имеют серьезный недостаток – они легко разрушаются под действием фермента пенициллиназы (β-лактамазы). Это послужило предпосылкой для синтеза полусинтетических пенициллинов на основе 6-амино-пенициллановой кислоты (6-АПК), которую чаще всего ацилируют по аминогруппе в 6-ом положении.
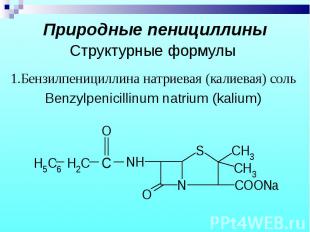
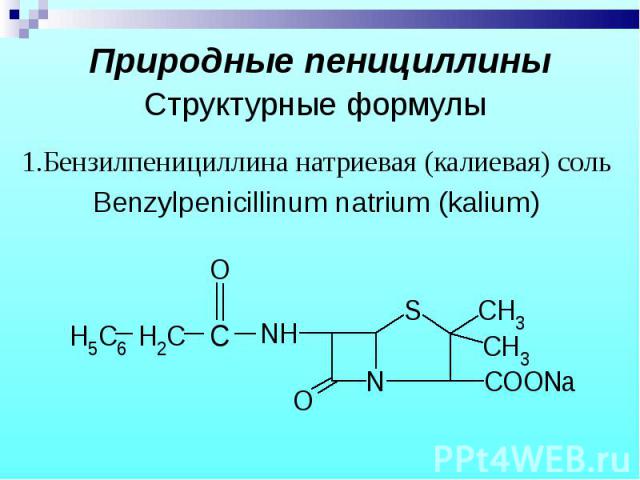
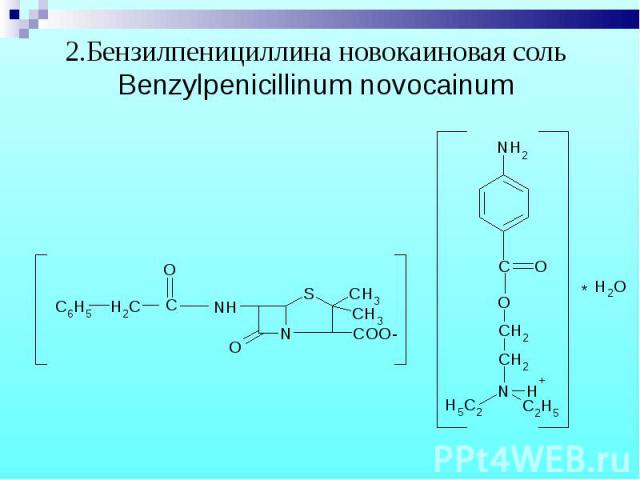
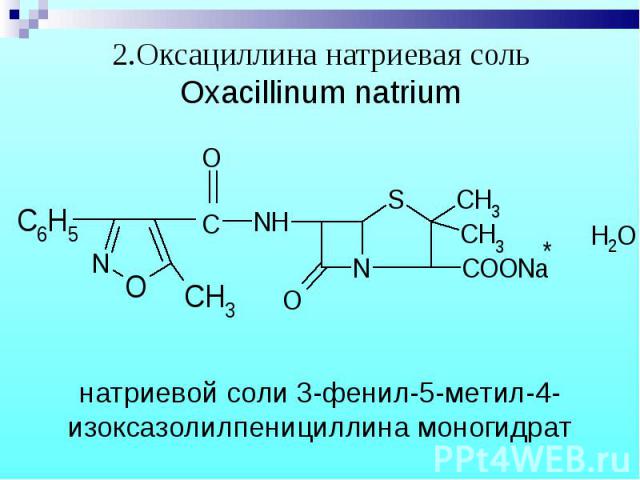
1.Бензилпенициллина натриевая (калиевая) соль 1.Бензилпенициллина натриевая (калиевая) соль Benzylpenicillinum natrium (kalium)
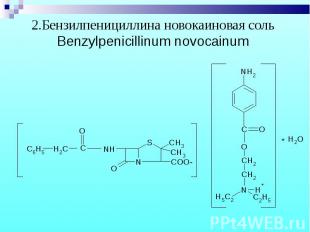
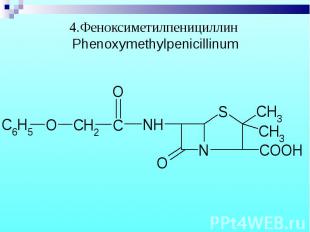
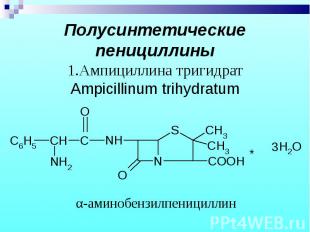
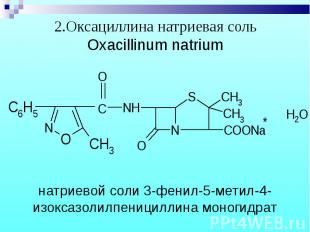
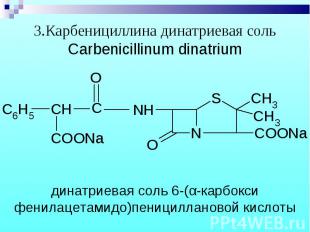
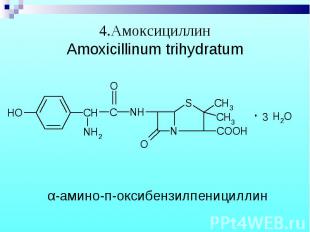

Препараты – белые кристаллические порошки, без запаха. Натриевые и калиевые соли слегка гигроскопичны, карбенициллина динатриевая соль – гигроскопична. Препараты – белые кристаллические порошки, без запаха. Натриевые и калиевые соли слегка гигроскопичны, карбенициллина динатриевая соль – гигроскопична.



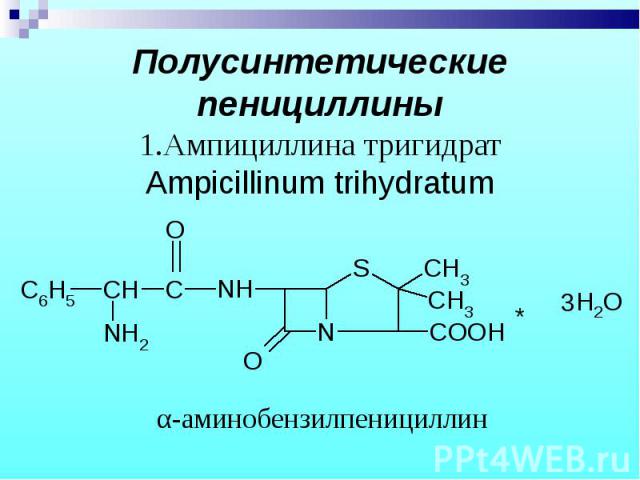
1. УФ – спектроскопия: соли бензилпенициллина λ = 280-286 нм. феноксиметилпенициллин λmax= 268-274 нм, λmin = 272 нм; ампициллин λmax = 256, 261, 267, λmin = 255, 260, 266 нм 1. УФ – спектроскопия: соли бензилпенициллина λ = 280-286 нм. феноксиметилпенициллин λmax= 268-274 нм, λmin = 272 нм; ампициллин λmax = 256, 261, 267, λmin = 255, 260, 266 нм

2. ИК - спектроскопия 2. ИК - спектроскопия 3. Удельное вращение 4. ВЭЖХ 5. ТСХ
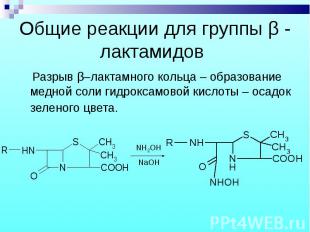
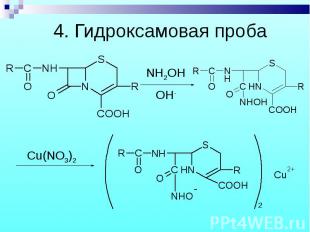
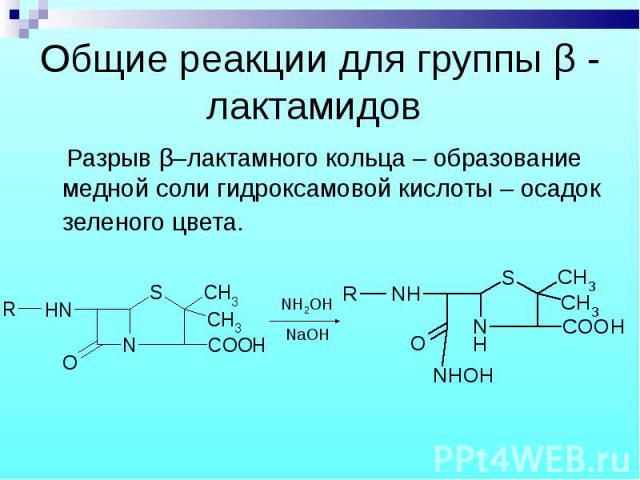
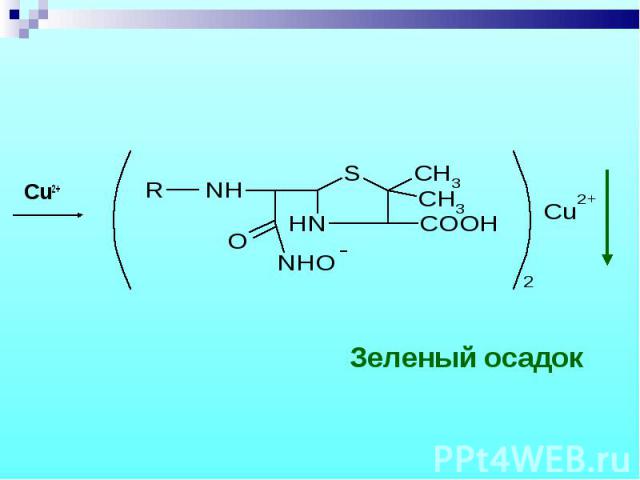
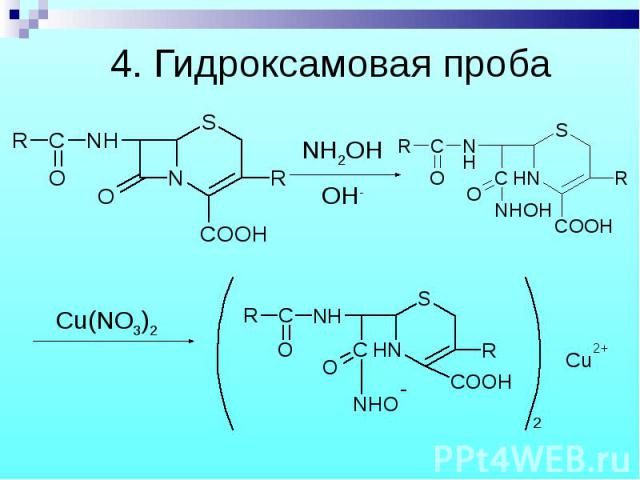
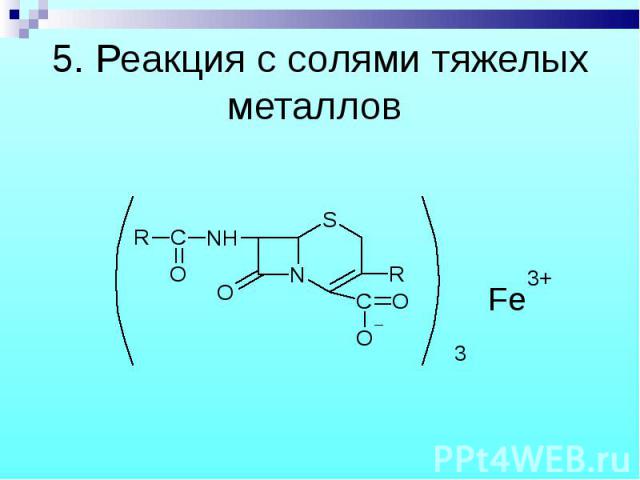
Разрыв β–лактамного кольца – образование медной соли гидроксамовой кислоты – осадок зеленого цвета. Разрыв β–лактамного кольца – образование медной соли гидроксамовой кислоты – осадок зеленого цвета.
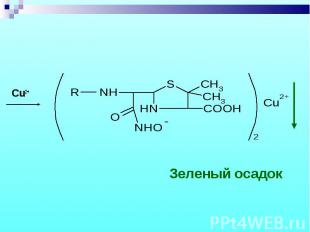
Cu2+ Cu2+
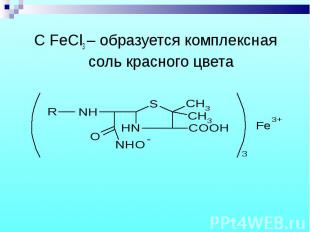
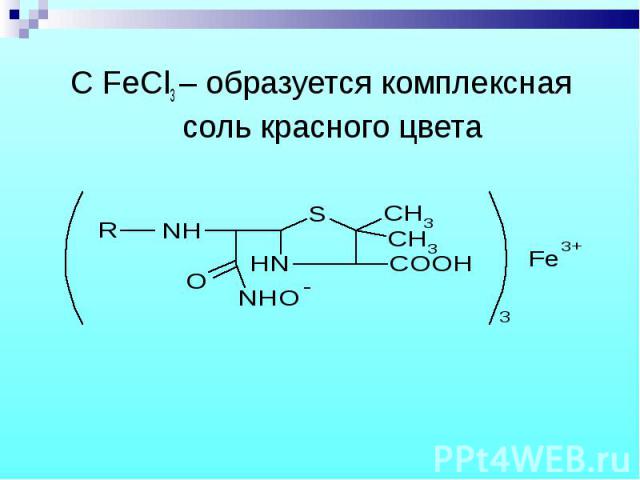
C FeCl3 – образуется комплексная соль красного цвета C FeCl3 – образуется комплексная соль красного цвета

а) с насыщенным раствором йода – коричневый осадок; а) с насыщенным раствором йода – коричневый осадок; б) с реактивом Майера – белый осадок.

Препарат прокаливают с солями Na, фильтруют: Препарат прокаливают с солями Na, фильтруют: а) к части фильтрата добавляют FeSO4, затем при подкислении приливают FeCl3. Образуется синий осадок – берлинская лазурь. 6NaCN + FeSO4 → Na4[Fe(CN)6] + Na2SO4; 3Na4[Fe(CN)6] + 4FeCl3 → Fe4[Fe(CN)6]3 + 12NaCl б) часть фильтрата нагревают с соляной кислотой, образуется H2S, который обнаруживается по почернению бумаги пропитанной Pb(CH3COO)2.

а) сплавление со щелочью с образованием S2- иона: а) сплавление со щелочью с образованием S2- иона: S2- + Pb2+ → PbS или с нитропруссидом Na – красно-фиолетовое окрашивание Na4[Fe(CN)5NOS] б) минерализация в концентрированной азотной кислоте (HNO3) до сульфат – иона: SO42- + Ba2+ → BaSO4 ↓
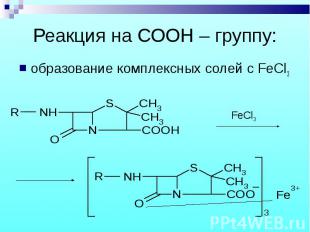
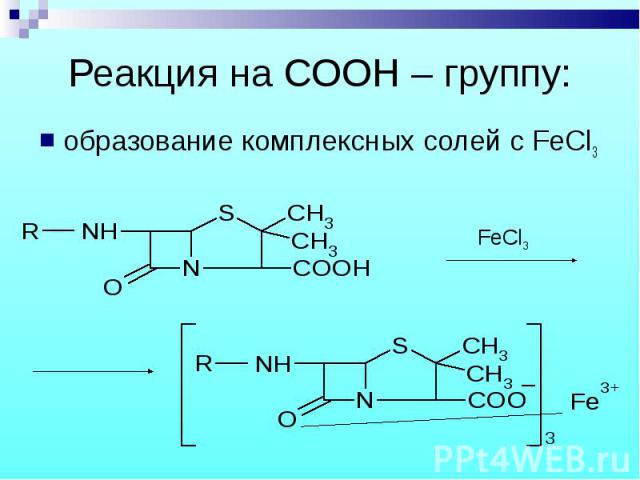
образование комплексных солей с FeCl3 образование комплексных солей с FeCl3

ампициллин – желтое окрашивание; ампициллин – желтое окрашивание; бензилпенициллин (Na, K) – желтый осадок; феноксиметилпенициллин – желто-зеленый осадок.
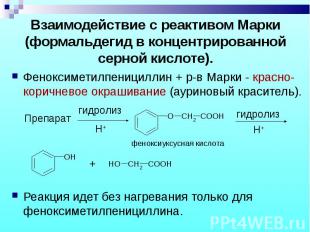
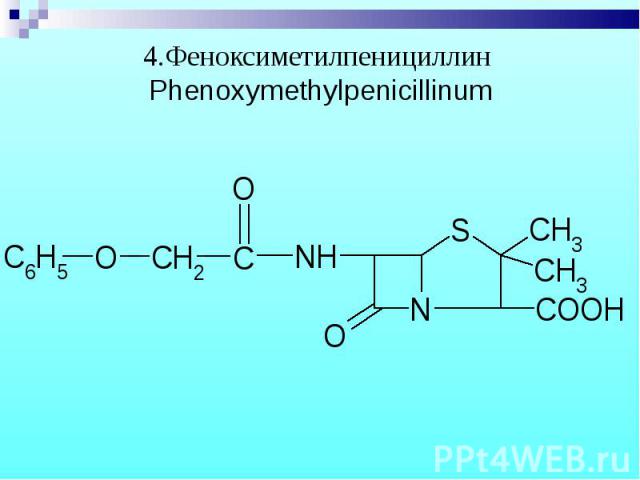
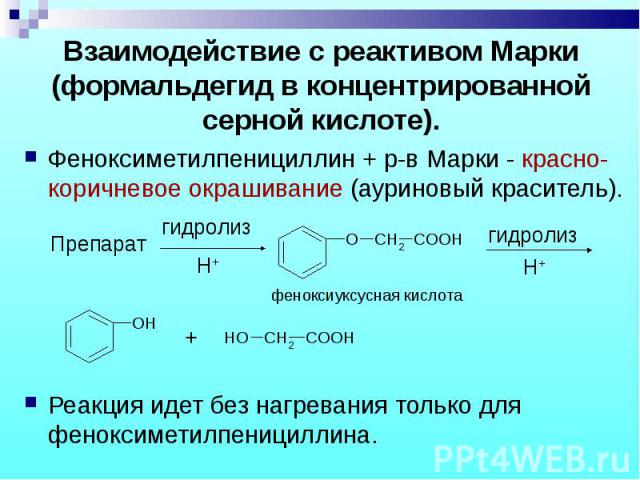
Феноксиметилпенициллин + р-в Марки - красно-коричневое окрашивание (ауриновый краситель). Феноксиметилпенициллин + р-в Марки - красно-коричневое окрашивание (ауриновый краситель). Реакция идет без нагревания только для феноксиметилпенициллина.

Соли бензилпенициллина + р-в Марки - красно-коричневое окрашивание Соли бензилпенициллина + р-в Марки - красно-коричневое окрашивание Ампициллин + р-в Марки - темно-желтое окрашивание Амоксициллин + р-в Марки - темно-желтое окрашивание

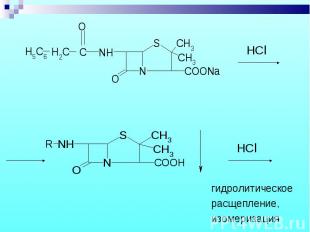
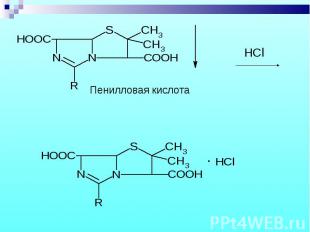
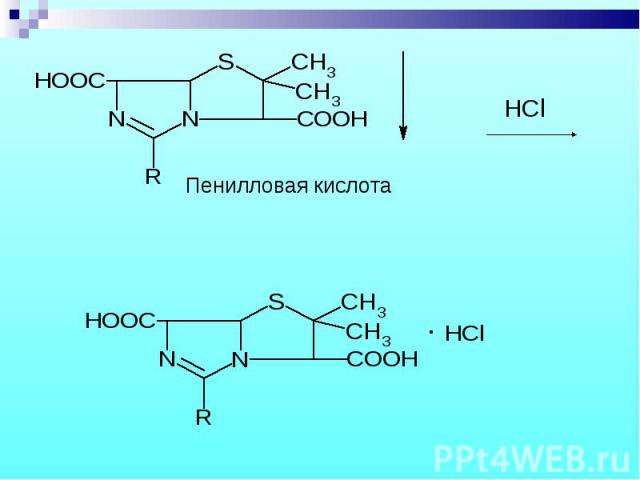
1. Бензилпенициллина Na и K соли 1. Бензилпенициллина Na и K соли Осаждение свободной кислоты при добавлении соляной кислоты – белый осадок, растворимый в избытке кислоты.

1) окраска пламени 1) окраска пламени 2) с кобальтинитритом Na на К+ - оранжево-желтый осадок.

Препарат выпаривают в смеси с дымящей HNO3, а затем прибавляют спиртовый раствор KOH и ацетон – фиолетовое окрашивание. Препарат выпаривают в смеси с дымящей HNO3, а затем прибавляют спиртовый раствор KOH и ацетон – фиолетовое окрашивание.

Выделение фенилуксусной кислоты после кипячения в 4% NaOH и последующего добавления избытка разбавленной H2SO4 (по запаху) Выделение фенилуксусной кислоты после кипячения в 4% NaOH и последующего добавления избытка разбавленной H2SO4 (по запаху)
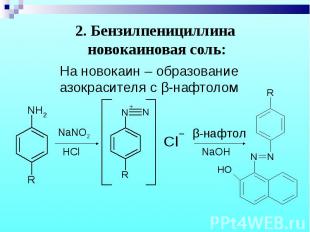
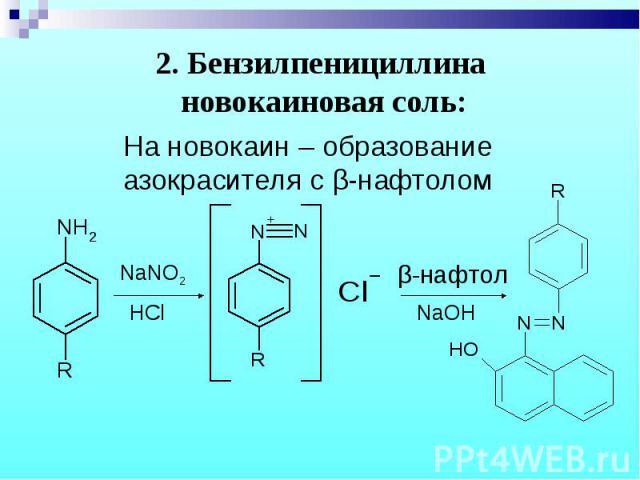
На новокаин – образование азокрасителя с β-нафтолом На новокаин – образование азокрасителя с β-нафтолом
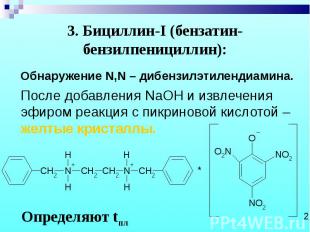
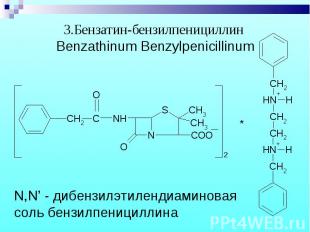
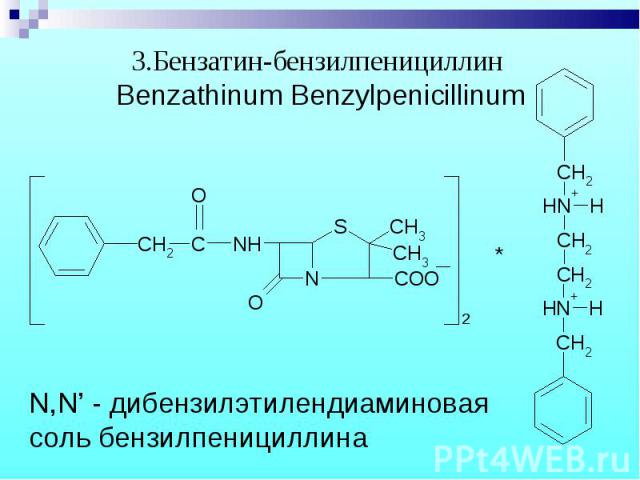
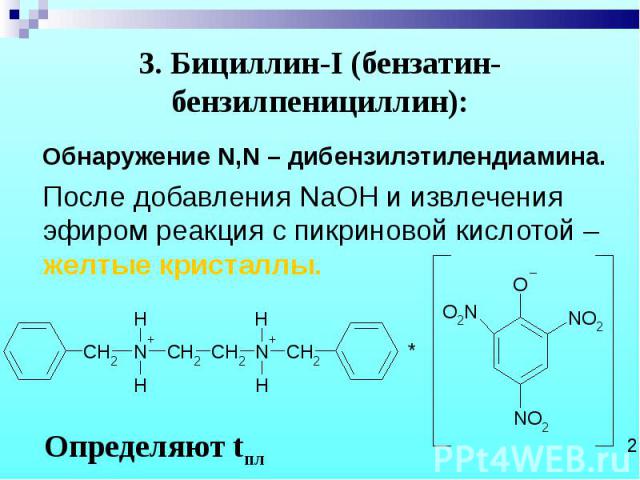
Обнаружение N,N – дибензилэтилендиамина. Обнаружение N,N – дибензилэтилендиамина. После добавления NaOH и извлечения эфиром реакция с пикриновой кислотой – желтые кристаллы.

Препарат + NaOH + KMnO4 – Препарат + NaOH + KMnO4 – зеленое окрашивание При нагревании появляется запах бензальдегида. Действуют K2Cr2O7 и ледяной CH3COOH – образуется золотисто-желтый осадок

с реактивом Фелинга – красно-фиолетовое окрашивание (образование медных комплексов). с реактивом Фелинга – красно-фиолетовое окрашивание (образование медных комплексов). нагревание с нингидрином – вишневое окрашивание за счет фениламиноуксусной кислоты.

реакция декарбоксилирования: реакция декарбоксилирования: добавляют Na2CO3 и фенолфталеин – розовое окрашивание, нагревают - окраска фенолфталеина исчезает.
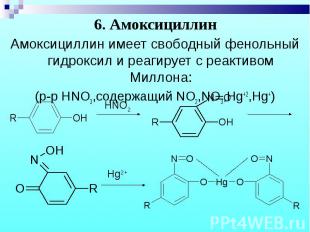
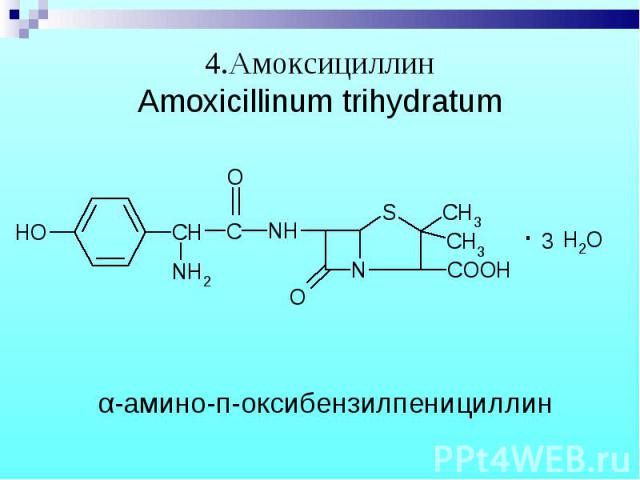
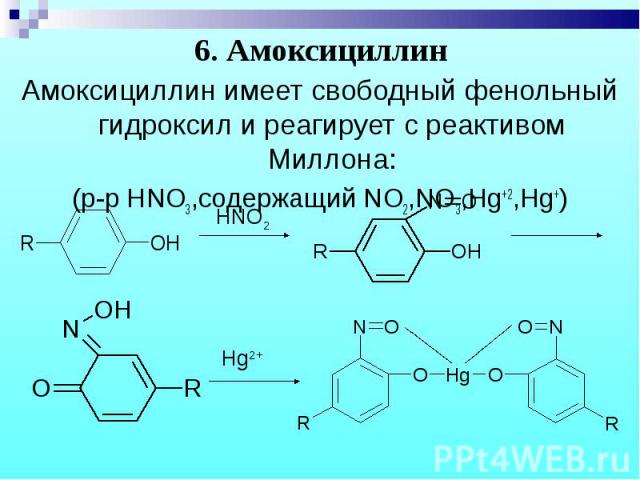
Амоксициллин имеет свободный фенольный гидроксил и реагирует с реактивом Миллона: Амоксициллин имеет свободный фенольный гидроксил и реагирует с реактивом Миллона: (р-р HNO3,содержащий NO2,NO3,Hg+2,Hg+)

кислотность или щелочность (рН = 5,5; 7,5); кислотность или щелочность (рН = 5,5; 7,5); потеря в массе при высушивании; испытания на токсичность, пирогенность, стерильность; термостабильность – при нагревании препарата до 1,5 часов при 1700С допускается снижение содержания суммы пенициллинов не более 10%;

светопоглощающие примеси; светопоглощающие примеси; йодсорбирующие примеси не более 6% (обратная йодметрия); остаточные растворители - ГЖХ; триметиламин, диметиланилин (ампициллин) – ГЖХ; феноксиуксусная кислота (феноксиметилпенициллин) - ВЭЖХ.

устойчив на холоду только в сухом состоянии, при повышенной температуре в присутствии влаги, следов тяжелых металлов в кислой и щелочной среде разлагается. Производные полиэтиленгиколя, ПАВ и других вспомогательные вещества снижают устойчивость. Наиболее устойчив при рН 6,0-7,0. устойчив на холоду только в сухом состоянии, при повышенной температуре в присутствии влаги, следов тяжелых металлов в кислой и щелочной среде разлагается. Производные полиэтиленгиколя, ПАВ и других вспомогательные вещества снижают устойчивость. Наиболее устойчив при рН 6,0-7,0.
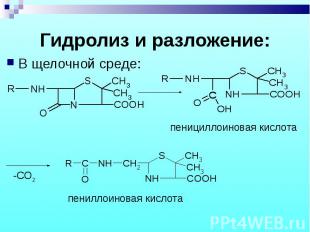
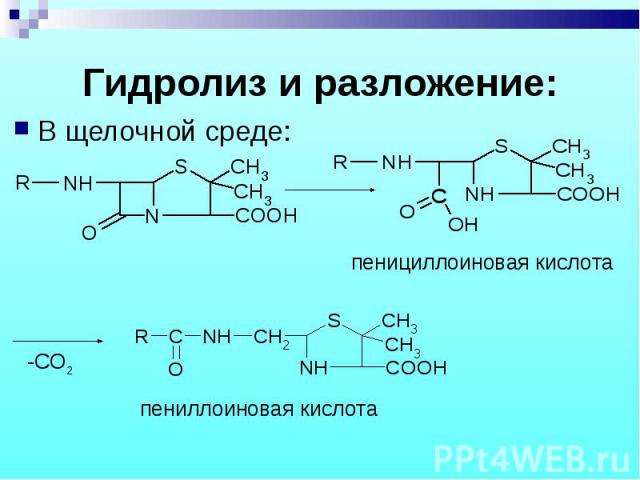
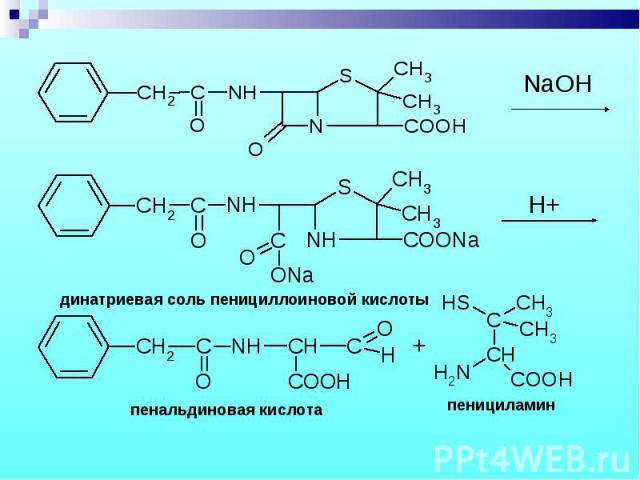
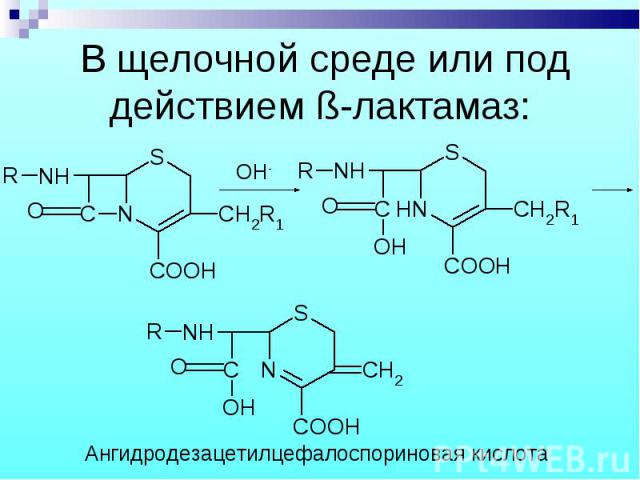
В щелочной среде: В щелочной среде:

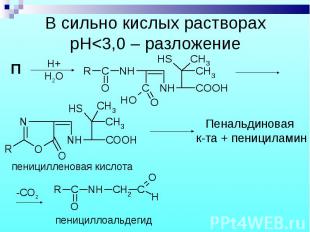
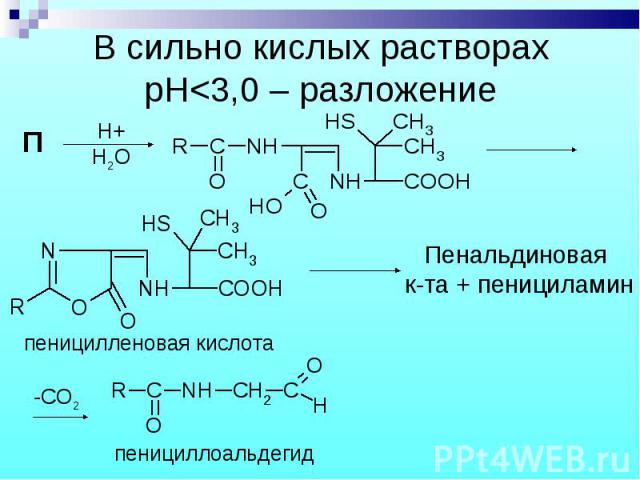
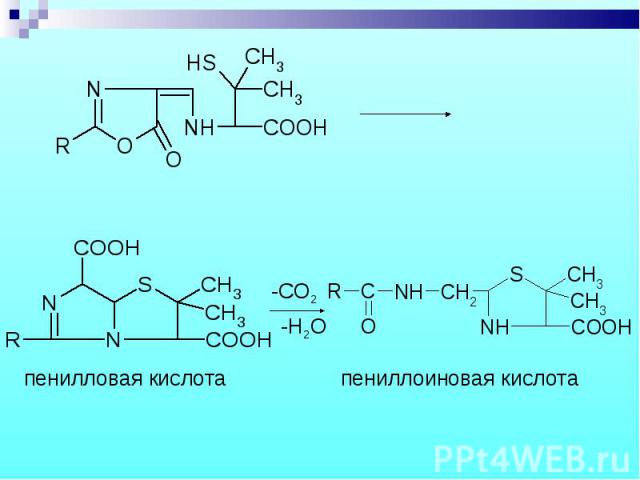
П П
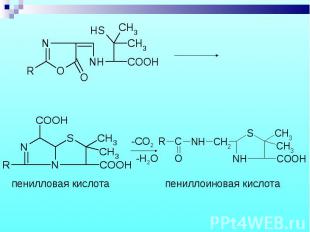

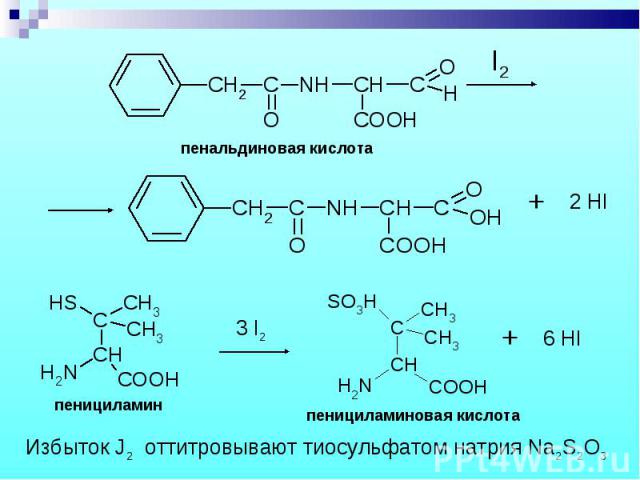
Состоит из двух этапов: определение суммы пенициллинов и определение соответствующего препарата. Состоит из двух этапов: определение суммы пенициллинов и определение соответствующего препарата. 1. Обратная йодометрия (ГФХ) продукты последовательного щелочного, а затем кислотного гидролиза окисляют избытком стандартного раствора йода J2 при рН 4,5
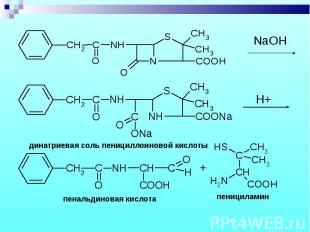
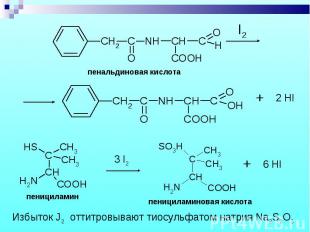
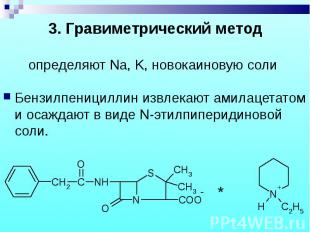
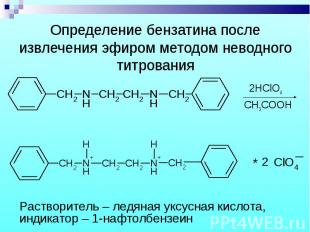
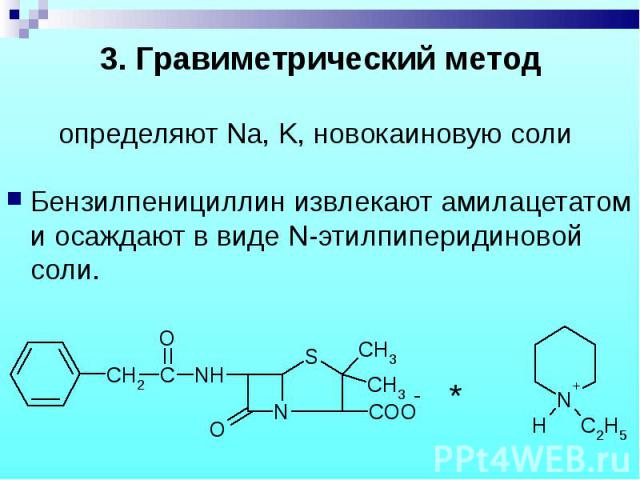
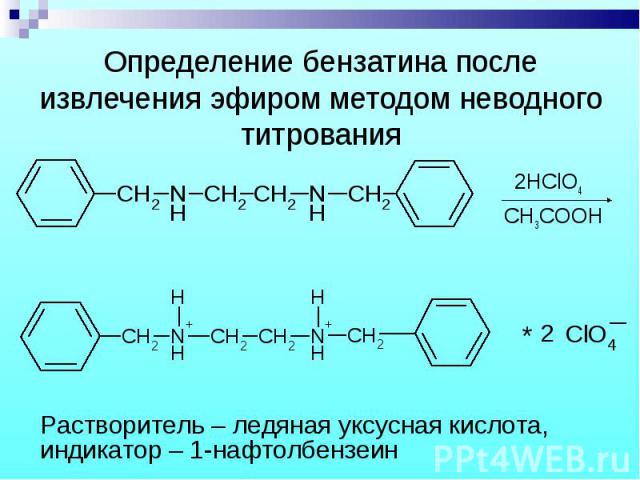
Бензилпенициллин извлекают амилацетатом и осаждают в виде N-этилпиперидиновой соли. Бензилпенициллин извлекают амилацетатом и осаждают в виде N-этилпиперидиновой соли.
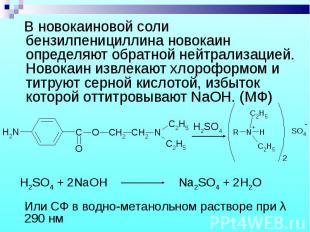
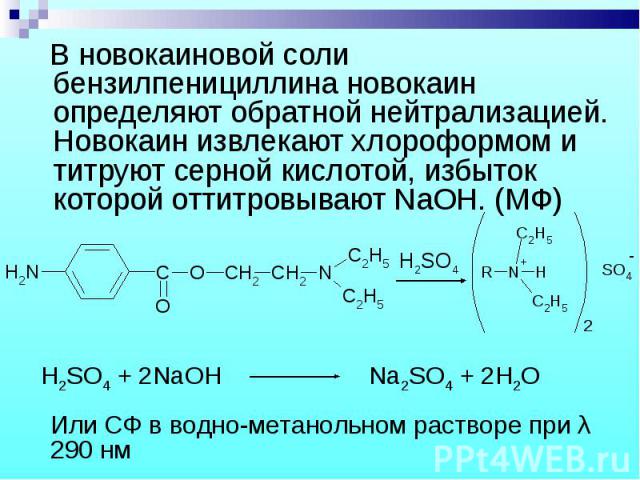
В новокаиновой соли бензилпенициллина новокаин определяют обратной нейтрализацией. Новокаин извлекают хлороформом и титруют серной кислотой, избыток которой оттитровывают NaOH. (МФ) В новокаиновой соли бензилпенициллина новокаин определяют обратной нейтрализацией. Новокаин извлекают хлороформом и титруют серной кислотой, избыток которой оттитровывают NaOH. (МФ)
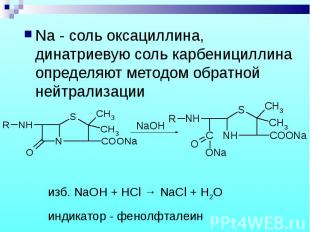
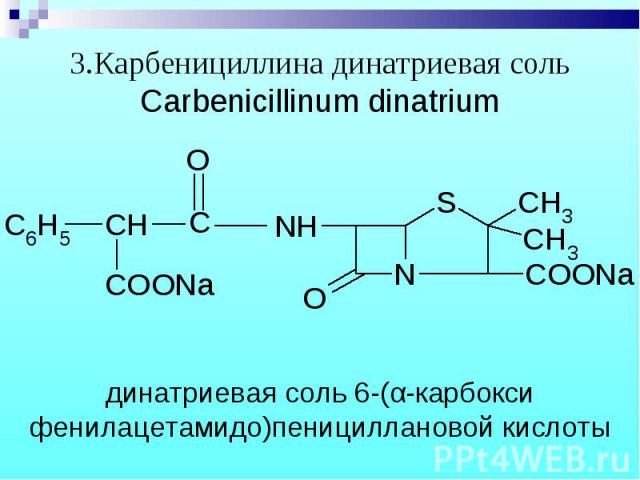
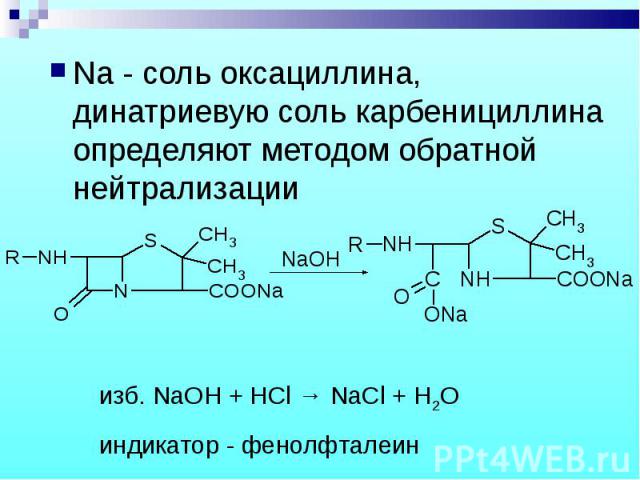
Na - соль оксациллина, динатриевую соль карбенициллина определяют методом обратной нейтрализации Na - соль оксациллина, динатриевую соль карбенициллина определяют методом обратной нейтрализации

Спектрофотометрический метод (ФС, МФ) Спектрофотометрический метод (ФС, МФ) а) Феноксиметилпенициллин в NaOH при λ 269 нм б) МФ – (препарат взаимодействует с раствором имидазола и HgCl2 – образуется соль пеницилленовой кислоты R-S-HgCl) λ=325 нм ФЭК

Активность пенициллинов – метод диффузии в агар Активность пенициллинов – метод диффузии в агар 1 ЕД = 0,5988 мкг химически чистой Na-соли бензилпенициллина

Применение: антибактериальные препараты. Применение: антибактериальные препараты. Совместимость: пенициллины нельзя объединять с аминогликозидами в одном шприце, т.к. образующиеся пенициллоиновые кислоты дают соли с основными аминогликозидами Хранение: в сухом месте при комнатной температуре, флаконы.

Фармакокинетика: выводятся с мочой 90% в неизменном виде, остальное в виде неактивных продуктов: пенициллоиновая кислота и диметилцистеин. Фармакокинетика: выводятся с мочой 90% в неизменном виде, остальное в виде неактивных продуктов: пенициллоиновая кислота и диметилцистеин. Феноксиметилпенициллин: 30-35% превращается в п-оксифеноксиметилпенициллин, в большей степени связывается с белками.
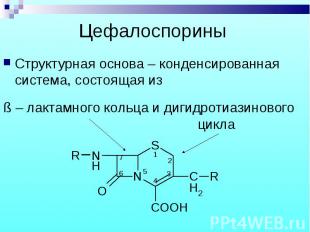
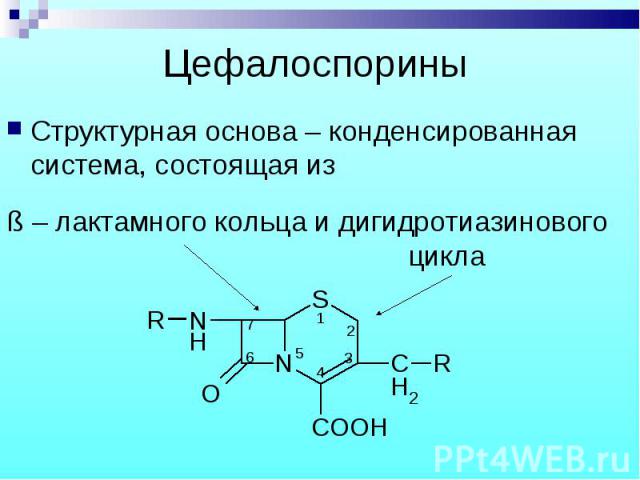
Структурная основа – конденсированная система, состоящая из Структурная основа – конденсированная система, состоящая из
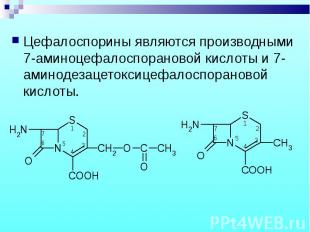
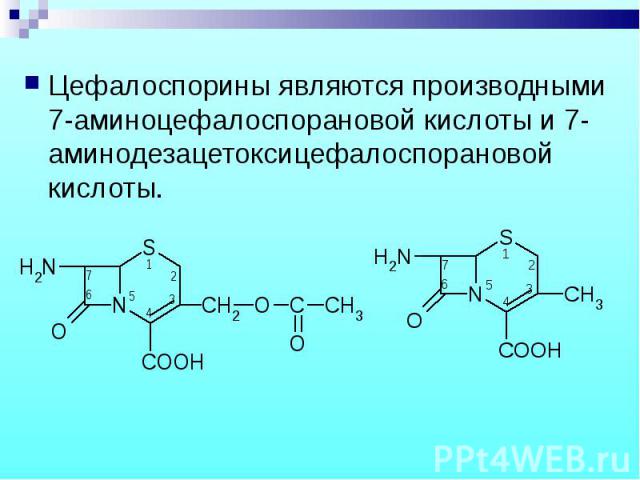
Цефалоспорины являются производными 7-аминоцефалоспорановой кислоты и 7-аминодезацетоксицефалоспорановой кислоты. Цефалоспорины являются производными 7-аминоцефалоспорановой кислоты и 7-аминодезацетоксицефалоспорановой кислоты.

природный цефалоспорин С – продукт жизнедеятельности плесневого гриба Cephalosporium salmosynnematum. Цефалоспорин С – токсичен и малоэффективен и является источником получения полусинтетических цефалоспоринов, а именно 7- аминоцефалоспорановой кислоты. природный цефалоспорин С – продукт жизнедеятельности плесневого гриба Cephalosporium salmosynnematum. Цефалоспорин С – токсичен и малоэффективен и является источником получения полусинтетических цефалоспоринов, а именно 7- аминоцефалоспорановой кислоты.
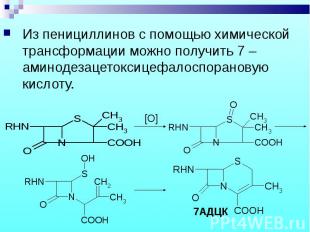
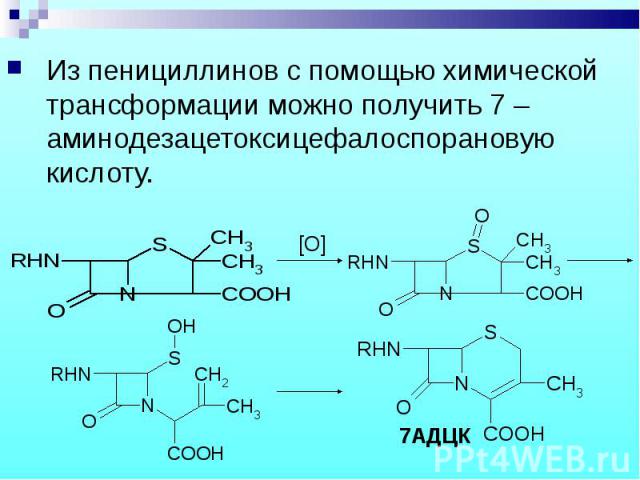
Из пенициллинов с помощью химической трансформации можно получить 7 –аминодезацетоксицефалоспорановую кислоту. Из пенициллинов с помощью химической трансформации можно получить 7 –аминодезацетоксицефалоспорановую кислоту.
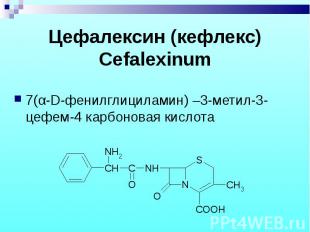
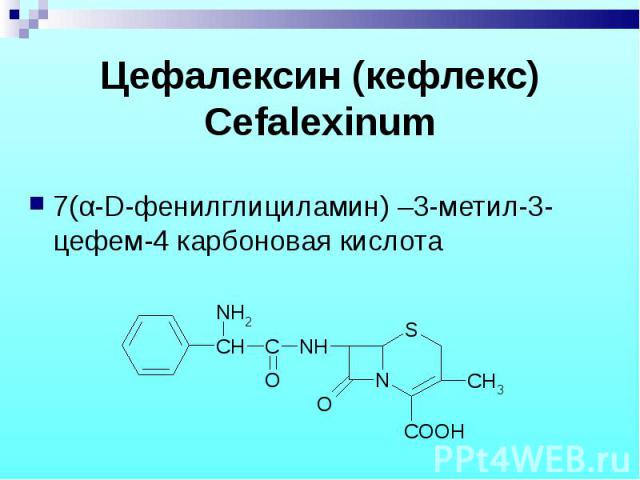
7(α-D-фенилглициламин) –3-метил-3-цефем-4 карбоновая кислота 7(α-D-фенилглициламин) –3-метил-3-цефем-4 карбоновая кислота
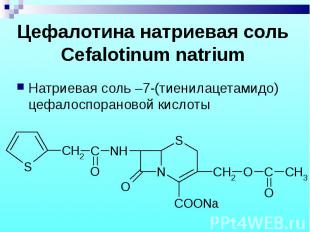
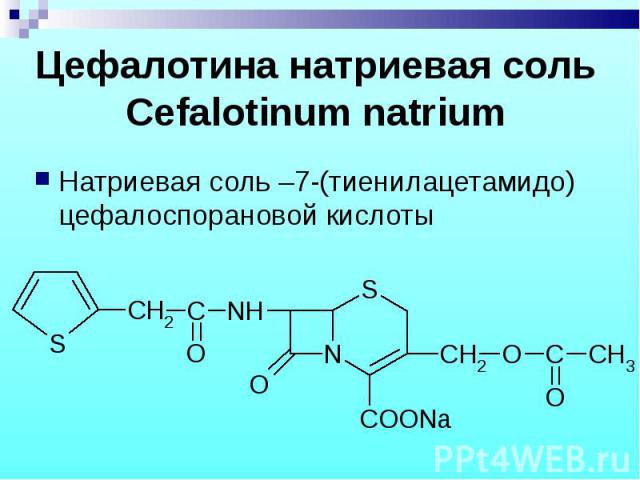
Натриевая соль –7-(тиенилацетамидо) цефалоспорановой кислоты Натриевая соль –7-(тиенилацетамидо) цефалоспорановой кислоты

Описание: белые кристаллические порошки, практически не растворимы в хлороформе и эфире. Цефалотина натриевая соль – легко растворима в воде, мало растворим в этаноле. Цефалотин – трудно растворим в воде, практически не растворим в этаноле. Цефалексин – амфотерен (-NH2, -СООН). Описание: белые кристаллические порошки, практически не растворимы в хлороформе и эфире. Цефалотина натриевая соль – легко растворима в воде, мало растворим в этаноле. Цефалотин – трудно растворим в воде, практически не растворим в этаноле. Цефалексин – амфотерен (-NH2, -СООН).

1.Спектрофотометрия в УФ и ИК областях. 1.Спектрофотометрия в УФ и ИК областях. λ = 260 нм, 4000-400 см-1, ЯМР. 2.ТСХ. 3.Удельное вращение.
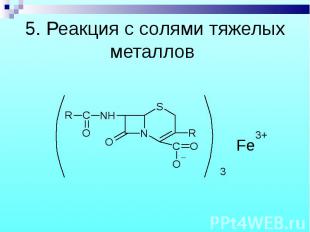

6. Цефалексин - на аминокислоту: нингидриновая проба и реакция комплексообразования с ионами Cu2+ в среде уксусной кислоты - после прибавления гидроксида натрия образуется оливково-зеленое окрашивание. 6. Цефалексин - на аминокислоту: нингидриновая проба и реакция комплексообразования с ионами Cu2+ в среде уксусной кислоты - после прибавления гидроксида натрия образуется оливково-зеленое окрашивание. 7. С реактивом Марки. 8. Со смесью 80% H2SO4 и 1% HNO3: цефалексин – желтое окрашивание; цефалотина натриевая соль – оливково-зеленое окрашивание. 9. Реакция на Na+. 10. Реакция на органически связанную S.

примеси – ВЭЖХ; примеси – ВЭЖХ; наличие специфических примесей – ГЖХ.

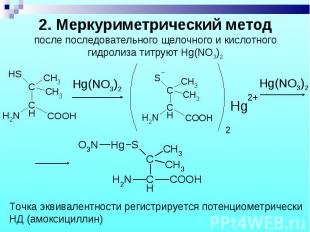
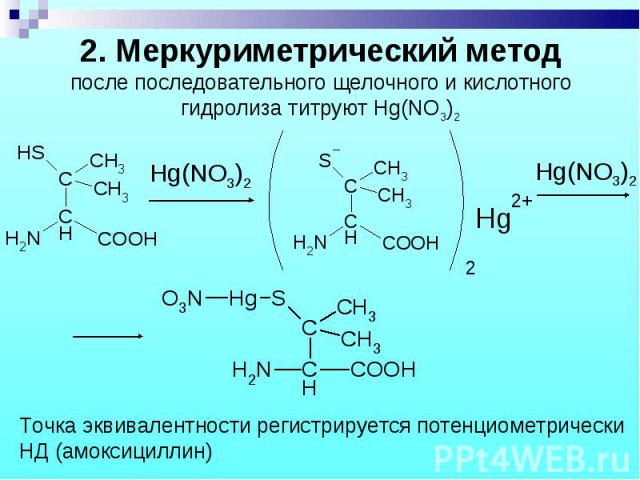
1. Обратная йодометрия: 1 эквивалент цефалоспорина требует 4 эквивалента J2. 1. Обратная йодометрия: 1 эквивалент цефалоспорина требует 4 эквивалента J2. 2. Меркуриметрия. 3. Цефалоспорин – неводное титрование: растворитель – смесь муравьиной и ледяной уксусной кислот и ацетона; титрант – диоксановый раствор HClO4; точка эквивалентности регистрируется потенциометрически. 4. СФМ. 5. ВЭЖХ.


Хранение: в хорошо укупоренной таре. Хранение: в хорошо укупоренной таре. Применение: антибактериальные (грамположительные и грамотрицательные микроорганизмы).
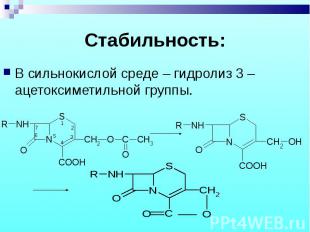
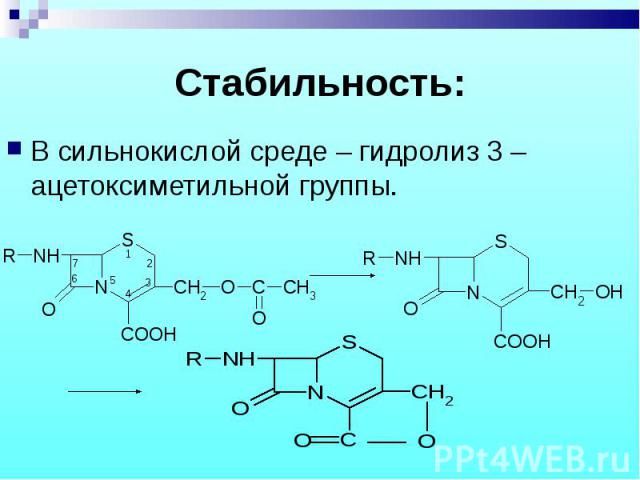
В сильнокислой среде – гидролиз 3 –ацетоксиметильной группы. В сильнокислой среде – гидролиз 3 –ацетоксиметильной группы.
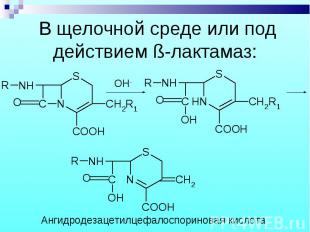
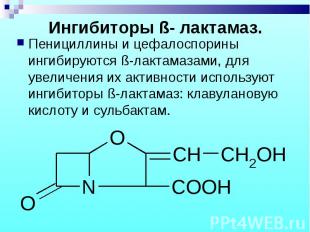
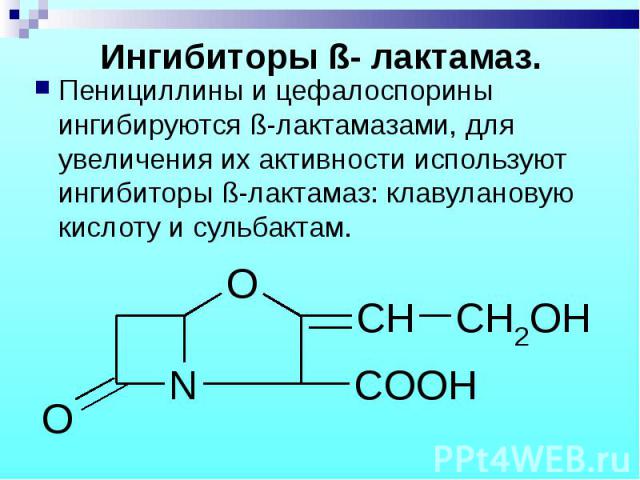
Пенициллины и цефалоспорины ингибируются ß-лактамазами, для увеличения их активности используют ингибиторы ß-лактамаз: клавулановую кислоту и сульбактам. Пенициллины и цефалоспорины ингибируются ß-лактамазами, для увеличения их активности используют ингибиторы ß-лактамаз: клавулановую кислоту и сульбактам.

Выделяется определенными штаммами микроорганизмов, обладает слабой антибактериальной активностью, но эффективно угнетает ß-лактамазы. В медицине часто применяется в комбинации с амоксициллином. Выделяется определенными штаммами микроорганизмов, обладает слабой антибактериальной активностью, но эффективно угнетает ß-лактамазы. В медицине часто применяется в комбинации с амоксициллином.
![3-(2-оксилиден)-7-оксо-4-окса-1-азобицикло [3.2.0] гептан-2 карбоксилат калия 3- 3-(2-оксилиден)-7-оксо-4-окса-1-азобицикло [3.2.0] гептан-2 карбоксилат калия 3-](https://fs1.ppt4web.ru/images/95289/115700/310/img79.jpg)
3-(2-оксилиден)-7-оксо-4-окса-1-азобицикло [3.2.0] гептан-2 карбоксилат калия 3-(2-оксилиден)-7-оксо-4-окса-1-азобицикло [3.2.0] гептан-2 карбоксилат калия

белый кристаллический порошок, гигроскопичен, легко растворим в воде, мало растворим в этаноле, очень мало растворим в ацетоне. белый кристаллический порошок, гигроскопичен, легко растворим в воде, мало растворим в этаноле, очень мало растворим в ацетоне.

ИК-спектроскопия; ИК-спектроскопия; ВЭЖХ; реакция на К+.

Испытание на чистоту и количественное определение проводят методом ВЭЖХ. Испытание на чистоту и количественное определение проводят методом ВЭЖХ. Стабильность: водные растворы разлагаются при рН 6,0-6,3. Метаболизм: до 60% препарата выводится с мочой в неизменном виде.
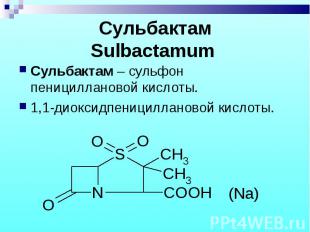
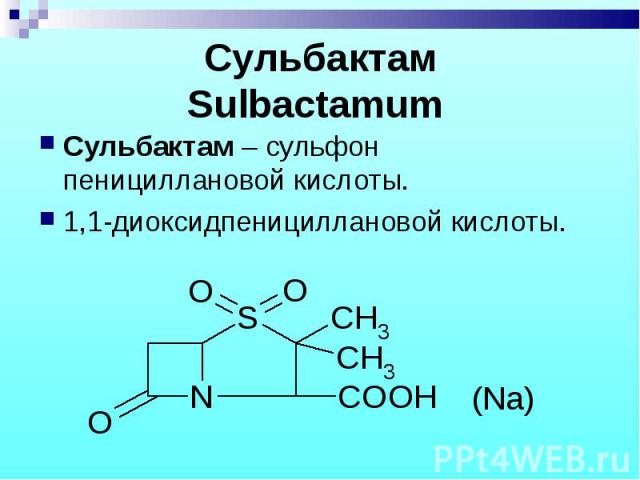
Сульбактам – сульфон пенициллановой кислоты. Сульбактам – сульфон пенициллановой кислоты. 1,1-диоксидпенициллановой кислоты.

белый кристаллический порошок, хорошо растворим в воде, натриевая соль легко растворима в воде, кислотах, мало растворима в ацетоне и хлороформе. белый кристаллический порошок, хорошо растворим в воде, натриевая соль легко растворима в воде, кислотах, мало растворима в ацетоне и хлороформе.

Идентификация: Идентификация: 1. ТСХ 2. Обнаружение Na+

Количественное определение Количественное определение 1. Спектрофотометрия 2. ВЭЖХ

Уназин состоит из ампициллина натрия и сульбактама натрия (2:1). Уназин состоит из ампициллина натрия и сульбактама натрия (2:1).

белый кристаллический порошок, легко растворим в воде. Уназин необратимо ингибирует ß-лактамазу и тем самым повышает устойчивость ампициллина. белый кристаллический порошок, легко растворим в воде. Уназин необратимо ингибирует ß-лактамазу и тем самым повышает устойчивость ампициллина.












![Препарат прокаливают с солями Na, фильтруют: Препарат прокаливают с солями Na, фильтруют: а) к части фильтрата добавляют FeSO4, затем при подкислении приливают FeCl3. Образуется синий осадок – берлинская лазурь. 6NaCN + FeSO4 → Na4[Fe(CN)6] + Na2SO4… Препарат прокаливают с солями Na, фильтруют: Препарат прокаливают с солями Na, фильтруют: а) к части фильтрата добавляют FeSO4, затем при подкислении приливают FeCl3. Образуется синий осадок – берлинская лазурь. 6NaCN + FeSO4 → Na4[Fe(CN)6] + Na2SO4…](https://fs1.ppt4web.ru/images/95289/115700/640/img23.jpg)
![а) сплавление со щелочью с образованием S2- иона: а) сплавление со щелочью с образованием S2- иона: S2- + Pb2+ → PbS или с нитропруссидом Na – красно-фиолетовое окрашивание Na4[Fe(CN)5NOS] б) минерализация в концентрированной азотной кислоте (HNO3) … а) сплавление со щелочью с образованием S2- иона: а) сплавление со щелочью с образованием S2- иона: S2- + Pb2+ → PbS или с нитропруссидом Na – красно-фиолетовое окрашивание Na4[Fe(CN)5NOS] б) минерализация в концентрированной азотной кислоте (HNO3) …](https://fs1.ppt4web.ru/images/95289/115700/640/img24.jpg)




























![3-(2-оксилиден)-7-оксо-4-окса-1-азобицикло [3.2.0] гептан-2 карбоксилат калия 3-(2-оксилиден)-7-оксо-4-окса-1-азобицикло [3.2.0] гептан-2 карбоксилат калия 3-(2-оксилиден)-7-оксо-4-окса-1-азобицикло [3.2.0] гептан-2 карбоксилат калия 3-(2-оксилиден)-7-оксо-4-окса-1-азобицикло [3.2.0] гептан-2 карбоксилат калия](https://fs1.ppt4web.ru/images/95289/115700/640/img79.jpg)