Презентация на тему: Закон сохранения массы веществ Ломоносова

Урок по химии Закон сохранения массы веществ. Уравнения химических реакций 900igr.net

Какое явление представлено в фильме?

Какое явление представлено в фильме?

Какое явление представлено в фильме?

Какие явления представлены на этом слайде? 1 2 3

Назовите признак химической реакции

Назовите признак химической реакции

Назовите признак химической реакции

Задание«Пирамида» Au Mo Mn Cu Cs Ag Mg Cr Md Al C Mt F Fe ЗСМВ Ниже представлена пятиэтажная пирамида, «строительными камнями» которой являются химические элементы. Найдите такой путь от ее основания к вершине, чтобы он содержал только элементы с постоянной валентностью. Закон сохранения массы веществ М.В. Ломоносова

Основные понятия для повторения Химический знак Химическая формула Атом Молекула Коэффициент Индекс Химическая реакция

Новые понятия Закон сохранения массы веществ Уравнение химической реакции Реагенты Продукты
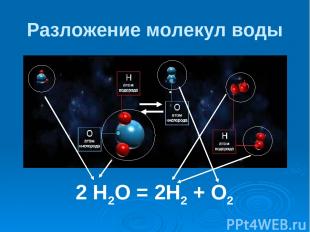
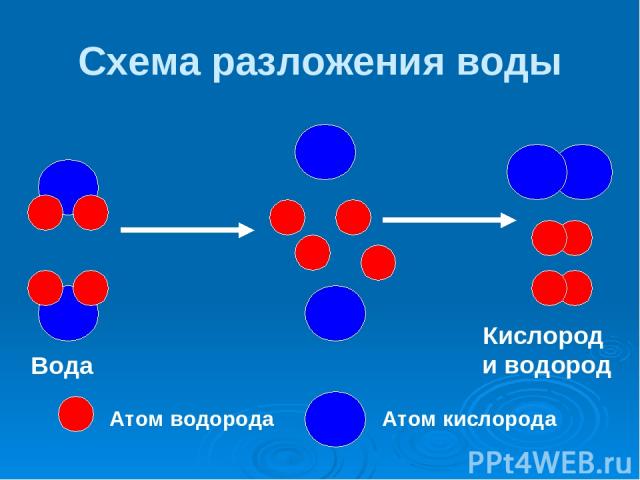
Разложение молекул воды 2 Н2О = 2Н2 + О2
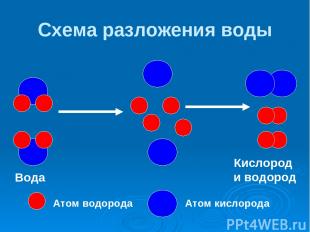
Схема разложения воды Атом водорода Атом кислорода ↯ Вода Кислород и водород

Закон сохранения массы веществ 2 Н2О → 2Н2 + О2 4Н + 2О → 4Н + 2О m1 m2 m3 m1 = m2 + m3 Лавуазье (1789) Ломоносов (1756) Пишем уравнения ХР Решаем задачи по уравнениям ХР 4 • 1 + 2 • 16 = 4 • 1 + 2 • 16 36 =36

Михаил Васильевич Ломоносов (1711 – 1765) Родился в 1711 году в России Русский ученый – природо-вед Основатель первого в Рос-сии Московского универси-тета Развивал атомно-молекуляр-ные представления о строе-нии веществ Открыл закон сохранения массы веществ

Формулировка закона сохранения массы веществ Масса веществ, получившихся в результате реакции Закон сохранения массы веществ М.В. Ломоносова Следствие закона Практическая реализация Число атомов каждого элемента должно быть одинаково до и после реакции Масса веществ, вступивших в реакцию
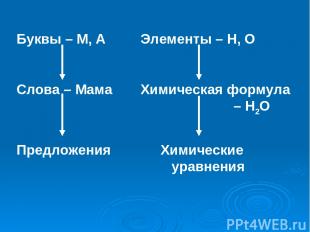
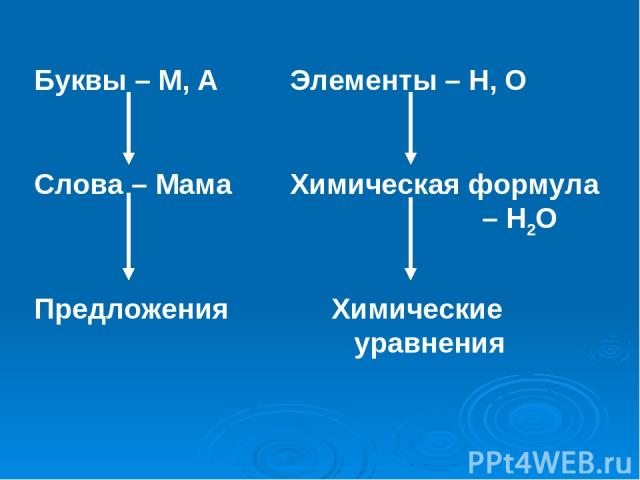
Буквы – М, А Элементы – Н, О Слова – Мама Химическая формула – Н2О Предложения Химические уравнения
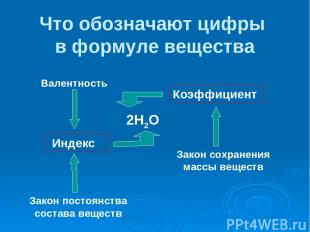
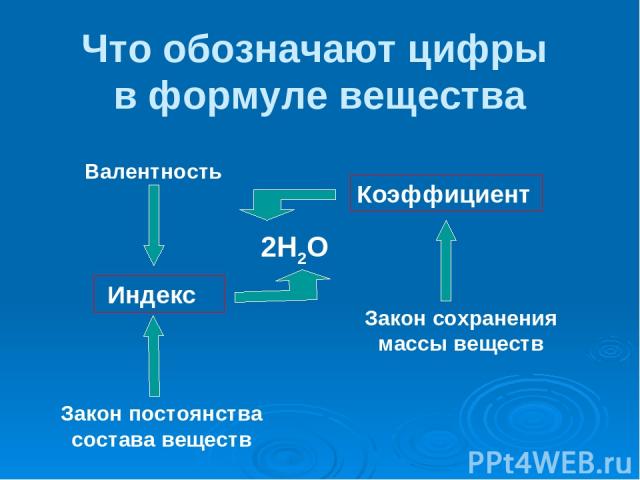
Что обозначают цифры в формуле вещества 2Н2О Коэффициент Индекс Закон сохранения массы веществ Закон постоянства состава веществ Валентность
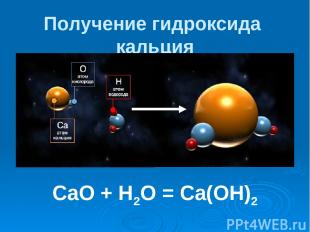
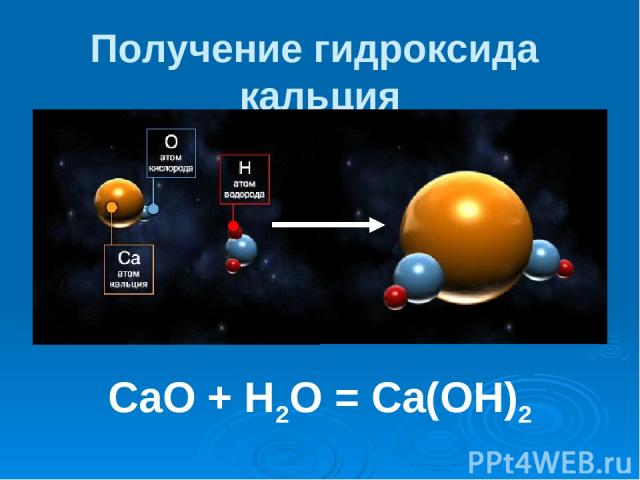
Получение гидроксида кальция CaO + H2O = Ca(OH)2

Уравнение химической реакции Условная запись химической реакции посредством химических формул, коэффициентов и математических знаков 2Н2О = 2Н2 + О2

Уравнения химических реакций
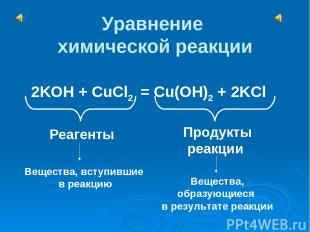
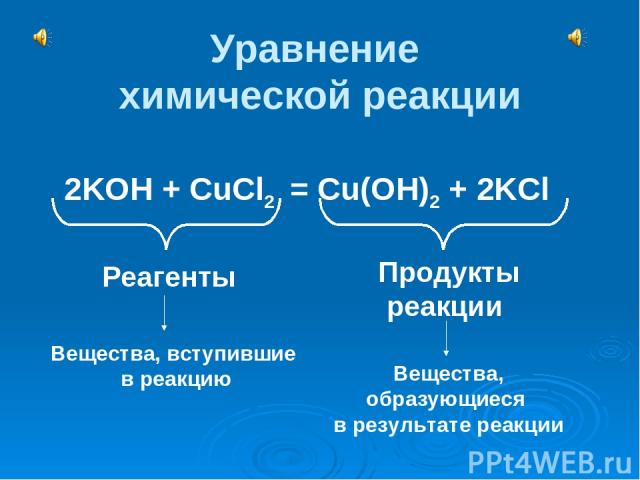
Уравнение химической реакции 2KOH + CuCl2 = Cu(OH)2 + 2KCl Реагенты Продукты реакции Вещества, вступившие в реакцию Вещества, образующиеся в результате реакции

Алгоритм составления уравнений химических реакций 1. В левой части записываются формулы веществ, которые вступают в реакцию: KOH + CuCl2 →. 2. В правой части (после стрелки) – формулы веществ, которые получаются в результате реакции: KOH + CuCl2 → Cu(OH)2 + KCl. 3. Затем с помощью коэффициентов уравнивается число атомов одинаковых химических элементов в правой и левой частях уравнения : 2KOH + CuCl2 = Cu(OH)2 + 2KCl.

Основные правила расстановки коэффициентов Расстановку коэффициентов начинают с элемента, чьих атомов в реакции участвует больше. Количество атомов кислорода до и после реакции в большинстве случаев должно быть четным. Если в реакции (обмена) участвуют сложные вещества, то расстановку коэффициентов начинают с атомов металлов или с кислотных остатков.
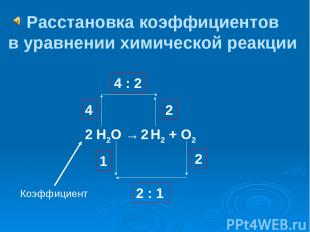
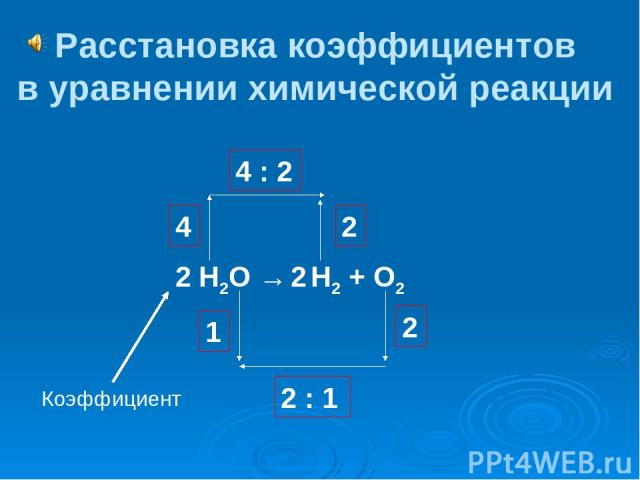
Н2О → Н2 + О2 Расстановка коэффициентов в уравнении химической реакции 4 4 : 2 2 2 1 2 : 1 2 2 Коэффициент

Что показывает химическое уравнение Какие вещества вступают в реакцию. Какие вещества образуются в результате реакции. Массу реагирующих веществ и веществ, образующихся в результате химической реакции. Отношение масс реагирующих веществ и веществ, образующихся в результате химической реакции.
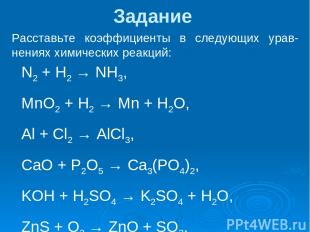
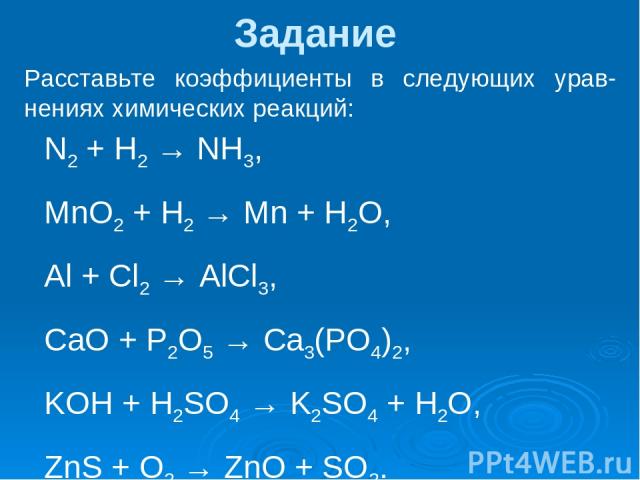
Задание Расставьте коэффициенты в следующих урав-нениях химических реакций: N2 + H2 → NH3, MnO2 + H2 → Mn + H2O, Al + Cl2 → AlCl3, CaO + P2O5 → Ca3(PO4)2, KOH + H2SO4 → K2SO4 + H2O, ZnS + O2 → ZnO + SO2.

Итоги урока Что сегодня мы повторили на уроке из того, что вы знали? Какие основные понятия мы вспомнили? Что вы сегодня узнали нового, чему научились на уроке? С какими новыми понятиями мы познакомились на сегодняшнем уроке? Как вы считаете, каков ваш уровень усвоения изученного учебного материала? Какие вопросы вызвали наибольшее затруднение?

Задания Масса колбы, в которой сожгли серу, после реакции не изменилась. В какой колбе (открытой или закрытой) проводилась реакция? На весах уравновесили огарок парафиновой свечи, затем зажгли его. Как измениться положение весов через некоторое время? При взаимодействии цинка массой 65 г с серой образовался сульфид цинка (ZnS) массой 97 г. Какая масса серы вступила в реакцию? В реакцию вступило 9 г алюминия и 127 г йода. Какая масса йодида алюминия (AlI3) при этом образуется?
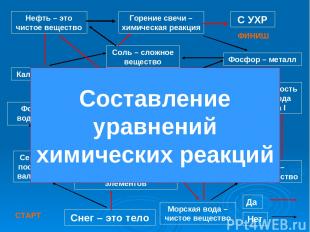
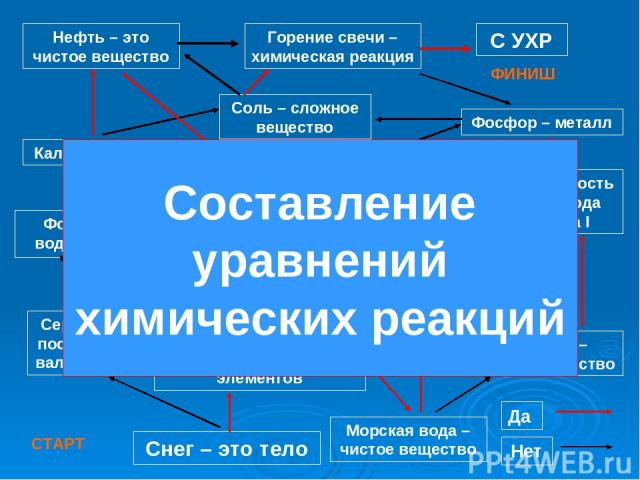
Формула воды – Н2О Кальций – метал Фосфор – металл Сложное вещество состоит из разных веществ Валентность водорода равна I Плавление сахара – химическое явление Горение свечи – химическая реакция Атом химически делим Сера имеет постоянную валентность Кислород – простое вещество Морская вода –чистое вещество Нефть – это чистое вещество Сложное вещество состоит из разных хим. элементов Снег – это тело Да Нет Соль – сложное вещество С УХР СТАРТ ФИНИШ Составление уравнений химических реакций

Уходя, задумайтесь, все ли мы теперь знаем о химических реакциях?