Презентация на тему: Закон сохранения массы веществ

Закон сохранения массы веществ. Уравнения химических реакций. Общая средняя школа № 36 имени Казыбек би Составила : учитель химии, биологии высшей квалификационной категории: Палжанова А.Ш. 2011 год 900igr.net

Единственный путь, ведущий к знанию, - это деятельность. Цели урока: Обучающие - экспериментально доказать закон сохранения массы веществ. На основе этого закона сформировать понятие о материальном балансе химической реакции. Сформировать понятие об уравнении химической реакции как об условной записи, отображающей превращения веществ. Развивающие - развивать умения ставить несложные проблемы, формулировать гипотезы и проводить их опытную проверку; совершенствовать умения работать с лабораторным оборудованием и реактивами ; развивать способность к логическому мышлению. Воспитательные - продолжить формирование научного мировоззрения учащихся; воспитывать коммуникативную компетентность, а также наблюдательность, внимание, инициативу. На примере жизни и деятельности М. В. Ломоносова воспитывать интерес к изучению химии.

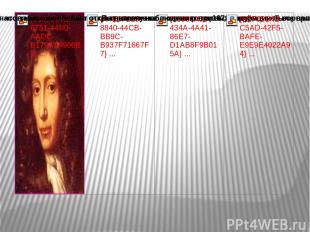
Открытие закона сохранения массы веществ 1789г. Роберт Бойль 1673г. 1748г. М. В. Ломоносов Антуан Лавуазье

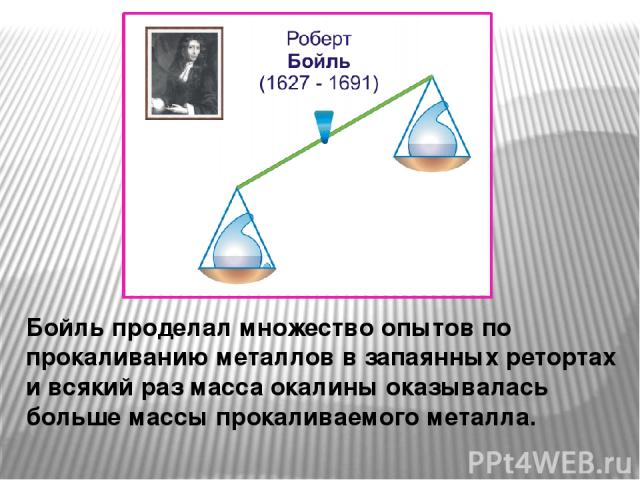
Бойль проделал множество опытов по прокаливанию металлов в запаянных ретортах и всякий раз масса окалины оказывалась больше массы прокаливаемого металла.
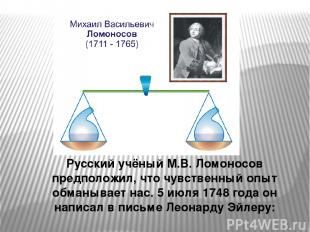
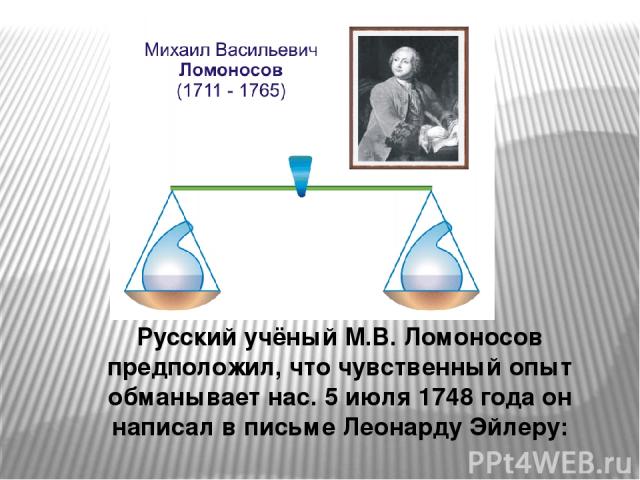
Русский учёный М.В. Ломоносов предположил, что чувственный опыт обманывает нас. 5 июля 1748 года он написал в письме Леонарду Эйлеру:

«Все перемены в натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимется, столько же присовокупится к другому. Так, ежели где убудет материи, то умножится в другом месте; сколько часов положит кто на бдение, столько же сну отнимет...»

«Масса веществ, вступивших в реакцию, равна массе образовавшихся веществ в результате реакции» - современная формулировка закона сохранения массы веществ.


Лишь в 1756 году Ломоносову удалось проверить опытным путём теоретически открытый закон сохранения массы веществ. Подобно Бойлю русский учёный делал опыт в запаянных ретортах. Но, в отличие от Бойля, Ломоносов взвешивал сосуды как до, так и после прокаливания не вскрывая.


Значительно позже этот закон,независимо от М.В. Ломоносова,был открыт французским ученым А.Лавуазье.


Химическая формула – условная запись состава вещества с помощью химических знаков и индексов. Индекс показывает число атомов в формульной единице вещества. Коэффициент показывает число несоединенных друг с другом частиц 5Н2О Коэффициент Химическая формула Индекс На основании данного закона составляют уравнения химических реакций с помощью химических формул, коэффициентов и математических знаков.

Химические уравнения Химическое уравнение – условная запись химической реакции с помощью химических формул и коэффициентов
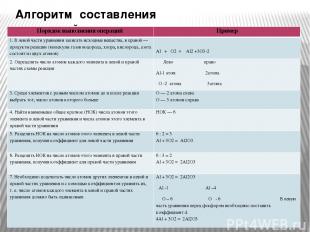
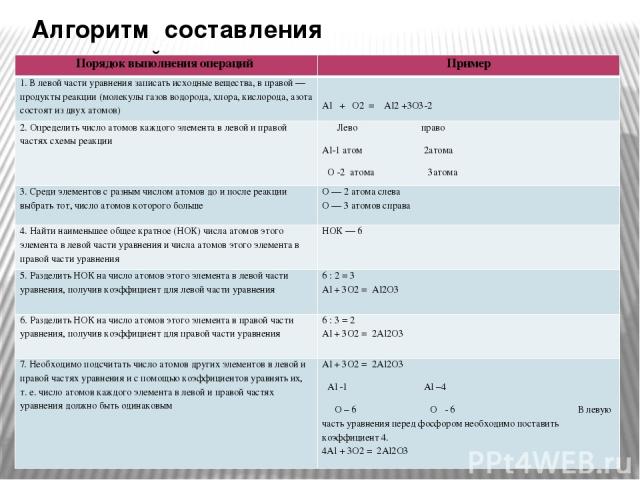
Алгоритм составления уравнений Порядок выполнения операций Пример 1. В левой части уравнения записать исходные вещества, в правой — продукты реакции (молекулы газов водорода, хлора, кислорода, азота состоят из двух атомов) Al + O2=Al2+3O3-2 2. Определить число атомов каждого элемента в левой и правой частях схемы реакции Лево право Al-1 атом 2атома O-2 атома 3атома 3. Среди элементов с разным числом атомов до и после реакции выбрать тот, число атомов которого больше O — 2 атома слева O — 3 атомов справа 4. Найти наименьшее общее кратное (НОК) числа атомов этого элемента в левой части уравнения и числа атомов этого элемента в правой части уравнения НОК — 6 5. Разделить НОК на число атомов этого элемента в левой части уравнения, получив коэффициент для левой части уравнения 6 : 2 = 3 Al + 3O2 = Al2O3 6. Разделить НОК на число атомов этого элемента в правой части уравнения, получив коэффициент для правой части уравнения 6 : 3 = 2 Al + 3O2 = 2Al2O3 7. Необходимо подсчитать число атомов других элементов в левой и правой частях уравнения и с помощью коэффициентов уравнять их, т. е. число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым Al + 3O2 = 2Al2O3 Al-1Al–4 O– 6O- 6В левую часть уравнения перед фосфором необходимо поставить коэффициент 4. 4Al + 3O2 = 2Al2O3

составить уравнения химических реакций 1) Са + О2 → СаО 2) К + О2 → K2O 3) H2 + O2 →H2O

Cu + Cl2 → CuCl2

Запишите уравнение реакции взаимодействия меди с кислородом ( вспомните видеофрагмент)

Домашнее задание: § 14,15 стр.40 №6,7.