Презентация на тему: Задачи по химии

Рассчитайте, сколько чистого оксида железа содержится в железой руде, если масса железной руды с примесью 12 % равна 250 г. Ответ: m(Fe2O3) = 220 г. Задача №1 Список задач ProPowerPoint.Ru

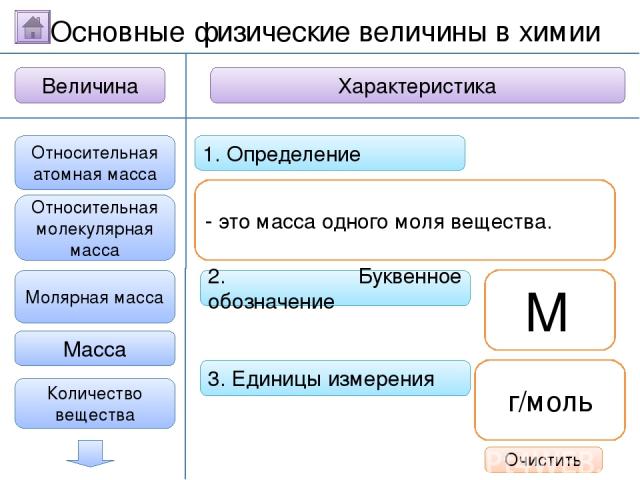
Справочный материал Кальцинированная сода (кристаллическая) - Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды). M(Na2CO3·10H2O) = 46+12+48+10*(2+16) = 286 г/моль. ProPowerPoint.Ru

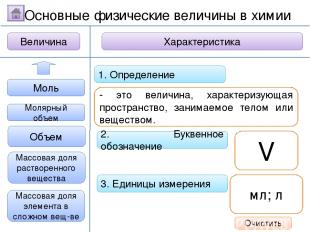
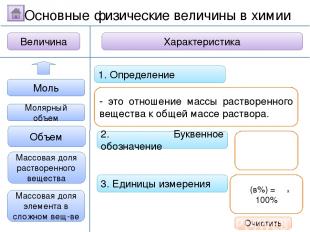
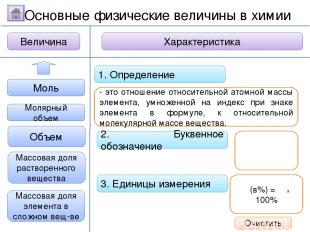
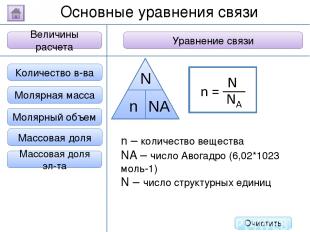
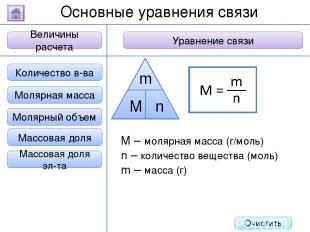
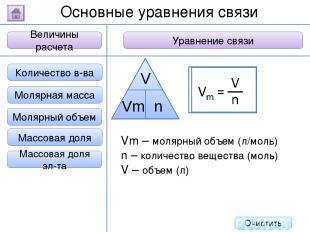
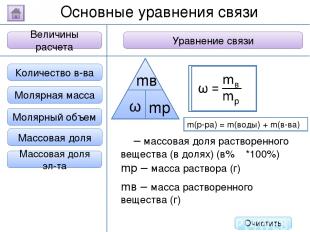
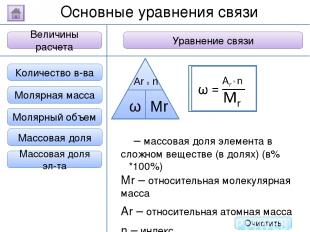
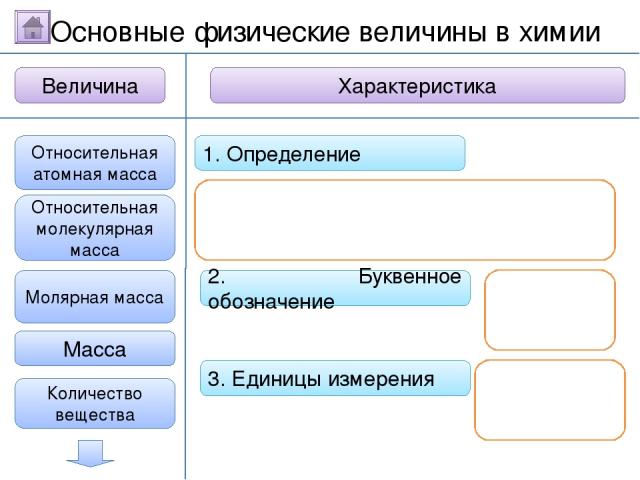
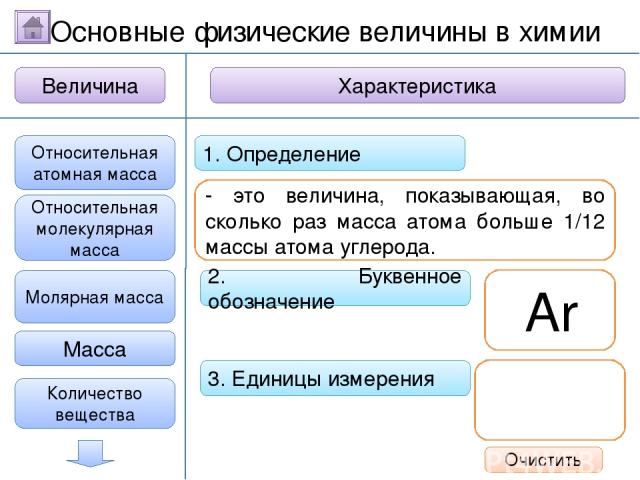
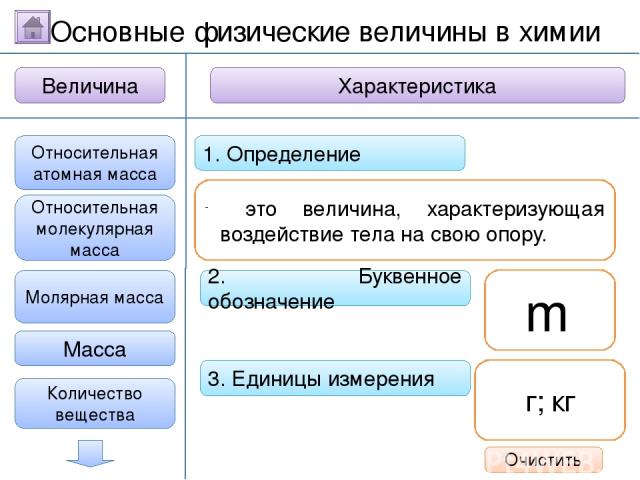
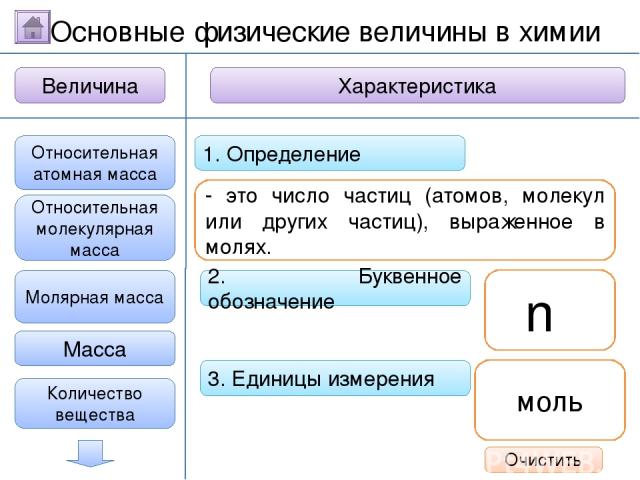
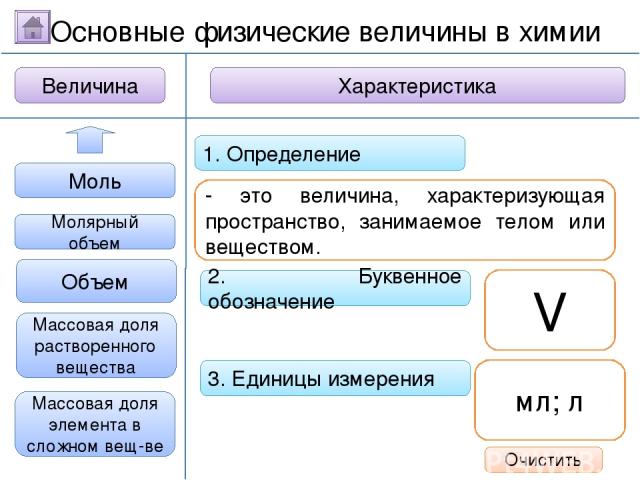
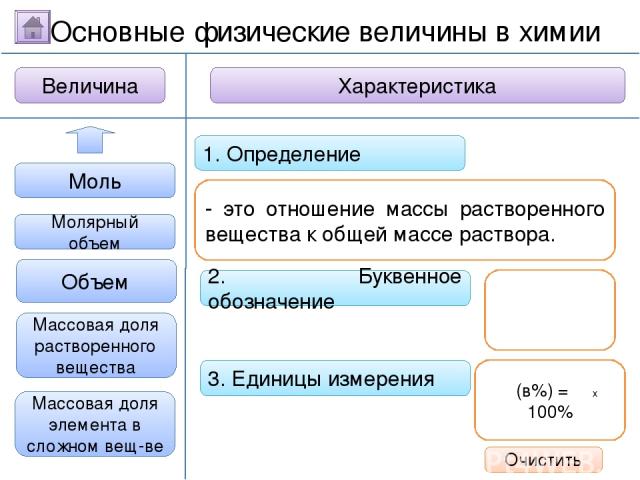
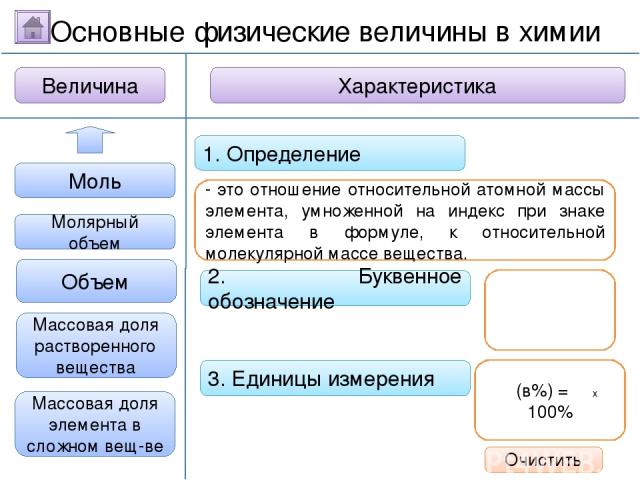
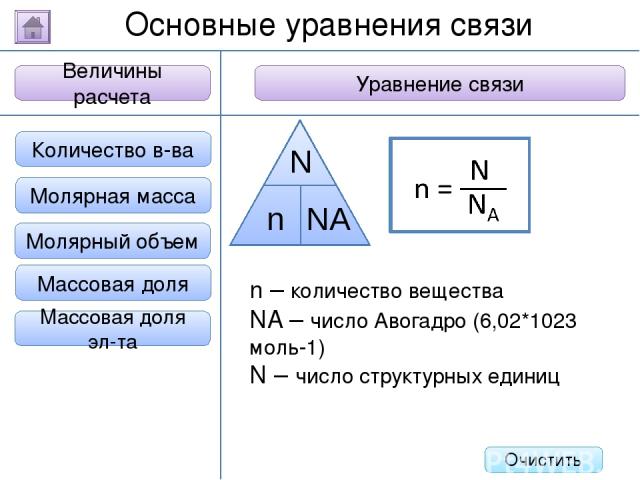
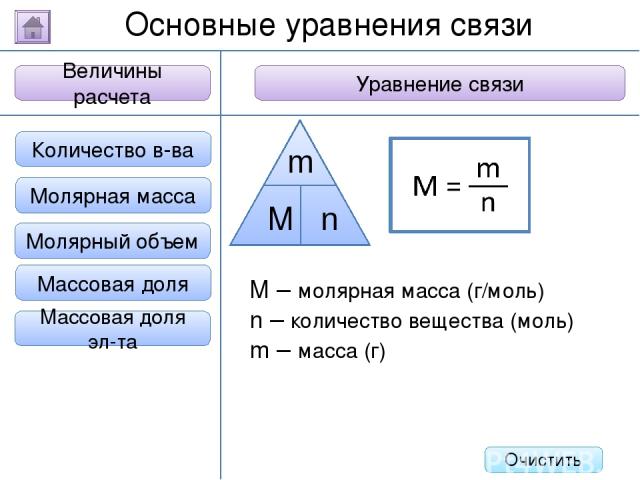
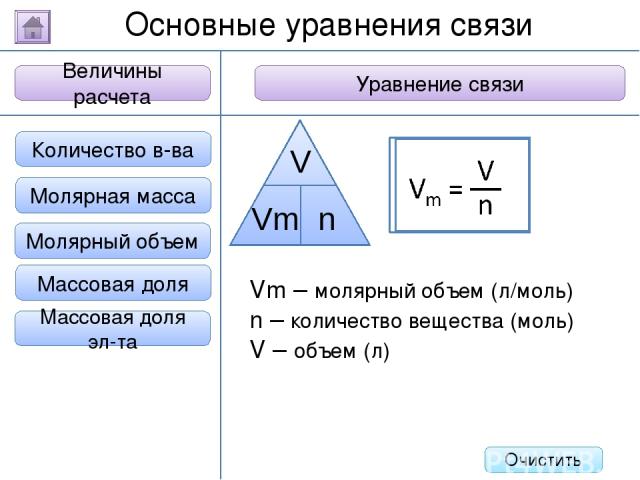
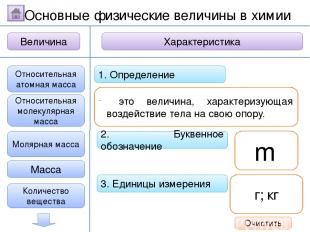
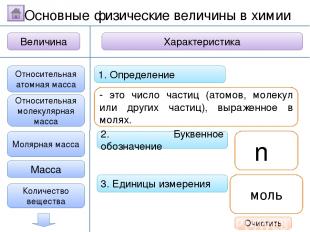
2. Буквенное обозначение 3. Единицы измерения 1. Определение Относительная молекулярная масса Масса Количество вещества - это величина, показывающая, во сколько раз масса атома больше 1/12 массы атома углерода. Ar Молярная масса Величина Характеристика Основные физические величины в химии Относительная атомная масса Очистить

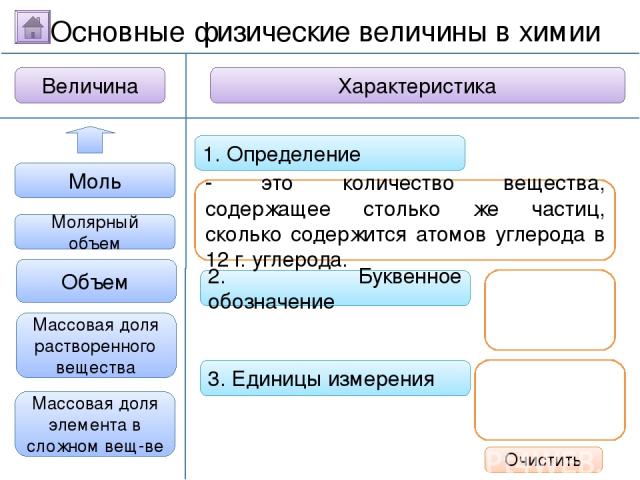
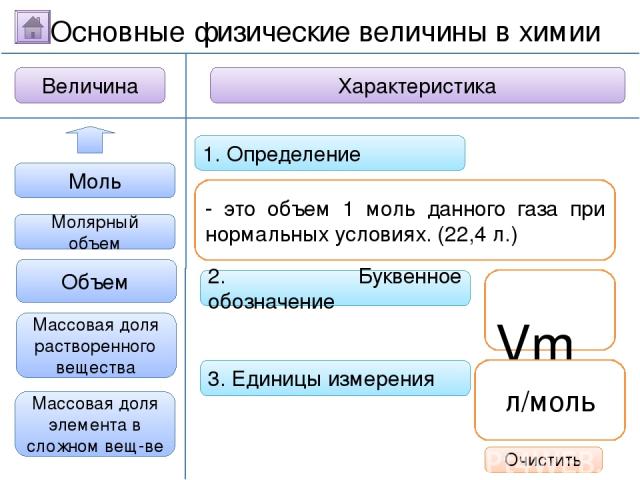
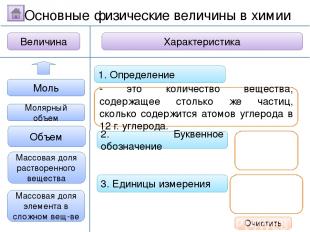
2. Буквенное обозначение 3. Единицы измерения 1. Определение Относительная молекулярная масса Масса Количество вещества Молярная масса Величина Характеристика Основные физические величины в химии Относительная атомная масса
Рассчитайте объём кислорода, который потребуется для сжигания 550 г сероводорода, содержащего 5 % примесей? Ответ: V(O2) = 516 л. Задача №5 Список задач ProPowerPoint.Ru

Какой объем углекислого газа выделится (н.у.) при обжиге известняка массой 250 кг, содержащего массовую долю примесей 20%? Ответ: V(CO2) = 44,8 м3 Задача №6 Список задач ProPowerPoint.Ru

Литература «ГИА-2013: Экзамен в новой форме. Химия. 9-й класс» Д.Ю. Добротин, А.А. Каверина. «Химия. 9-й класс. Подготовка к ГИА-2011» В.Н. Доронькин. «Химия. 9-й класс. Готовимся к экзаменам» М.Г, Снастина. Интернет-ресурсы Фон для презентации - http://pedsovet.su/load/321-4-2 Картинки - http://arthimik.ru/osuschestvlenie-chimicheskich-protsessov/chimicheskie-protsessi; http://lesnopak.com/khimicheskie-reaktivy; http://uroki-shkola.ru/osnovnye-ximicheskie-ponyatiya-urok-ximii-v-8-klasse.html; http://photobank.3vx.ru/13886-himicheskie_kolbyi_s_reagentami_3d_vizualizatsii_stokovoe_foto_.html ProPowerPoint.Ru

Вычислите объём аммиака, который можно получит при синтезе из водорода и 30 г азота, содержащего 2% примесей. Определите количество вещества израсходованного водорода. Ответ: V(NH3) = 47 л; n(H2) = 3,15 моль. Задача №8 Список задач ProPowerPoint.Ru
Вычислите массу оксида магния, которая получается при обжиге карбоната магния массой 252 кг с массовой долей примесей в нем 3%. Ответ: m(MgO) = 116,4 кг Задача №9 Список задач ProPowerPoint.Ru
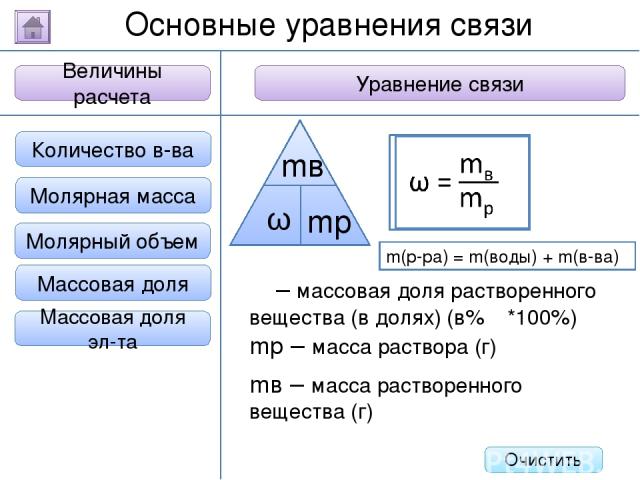
Задания с развернутым ответом (С2). Тип 2. Дано: Найти: Решение: Ответ: BaCl2 + H2SO4 = BaSO4 + 2HCl m(BaCl2) = m(р-ра) * w = 80 * 0,065 = 5,2 г M(BaCl2) = 137 + 2*35,5 = 208 г/моль n(BaCl2) = m/M = 5,2 г : 208 г/моль = 0,025 моль => n(BaSO4) = 0,025 моль M(BaSO4) = 137 +32 + 16*4 = 233 г/моль m(BaSO4) = M*n = 0,025 моль * 233 г/моль = 5,825 г m(BaSO4) - ? К 80 г. раствора хлорида бария с массовой долей растворенного вещества 6,5% добавили избыток раствора серной кислоты. Вычислите массу выпавшего осадка. m(BaSO4) = 5,825 г. Список задач m(р-ра) = 80 г w(BaCl2) = = 6,5% = 0,065
Задача №10 Определите форму гипса, если известно, что в его состав входит 20,93% воды: CaSO4 * 5H2O CaSO4 * H2O CaSO4 * 2H2O 2CaSO4 * H2O Список задач ProPowerPoint.Ru
Задания с развернутым ответом (С2). Тип 1. Задача №1 Задача №2 Задача №3 Задача №4 Задача №5 Задача №6 Задача №7 Задача №8 Задача №9 ProPowerPoint.Ru

Задача №10 Какой объем (н.у.) оксида углерода (IV) выделится при взаимодействии 25 г. карбоната натрия, содержащего 5% примесей, с соляной кислотой. Ответ: V(CO2) = 5,0 л. Список задач ProPowerPoint.Ru