Презентация на тему: Типы химических связей

ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ Цели: Дать понятия ионной, ковалентной, металлической, водородной хим.связям; Научить определять и записывать схемы образования ионной и ковалентной связи для двухатомных молекул. МОУ лицей №18 учитель химии Калинина Л.А. . 900igr.net

АТОМЫ Na0 - 1s22s22p63s1 Mg0 - 1s22s22p63s2 F0 - 1s22s22p5 Cl0 - 1s22s22p63s23p5 число протонов и электронов одинаковое количество, атом нейтрален.

ИОНЫ Na1+ - 1s22s22p63s0 Mg2+ - 1s22s22p63s0 F1- - 1s22s22p6 Cl1- - 1s22s22p63s23p6 Число протонов и электронов разное – это ионы.

ИОНЫ – заряженные частицы, которые образуются в результате присоединения или отдачи электронов. Если е - отдаются – ион заряжается положительно. Если е - присоединяются – ион заряжается отрицательно.

ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ЭО атома, условная величина, характеризующая способность атома в молекуле притягивать электроны. ЭО в периоде увеличивается ЭО в группе возрастает САМЫЙ электроотрицательный элемент фтор.

Ионная связь образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому. ИОННАЯ СВЯЗЬ, образуемая в результате электростатического притяжения. Например: Na1+ и Cl1-, Li1+ и F1- •• Na1+ + Cl1- = Na( :Cl:) • •

Физические свойства веществ с ионным типом связи: твердые, тугоплавкие, не имеющие запаха, часто хорошо растворимые в воде. Вещества с ионном связью, образуют ионную кристаллическую решетку.

Металлическая связь возникает в результате движения свободных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами.

Физические свойства. Валентные электроны принадлежат одновременно всем атомам металла, свободно перемещаясь по всему кристаллу. Образуя единое электронное облако («электронный газ»). Электроны обладают свойствами волны, они «размазаны» по всему куску металла. В этом типе связи электроны обусловливают высокую тепло- и электропроводность, металлический блеск

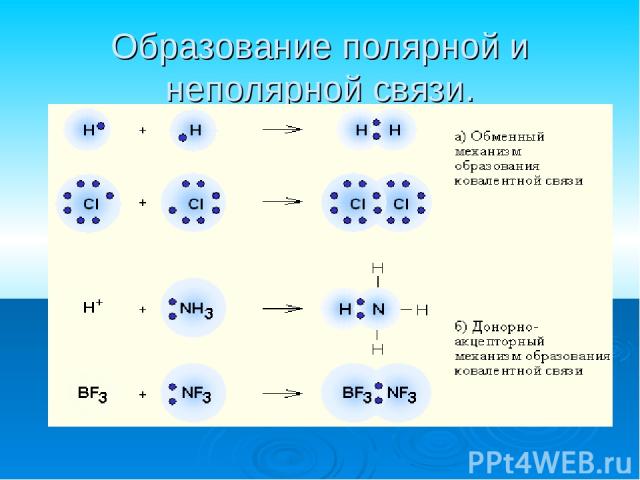
Ковалентная связь наиболее общий вид химической связи, возникающий за счет образования общей электронной пары обменный механизм - когда каждый из взаимодействующих атомов поставляет по одному электрону донорно-акцепторный механизм - электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
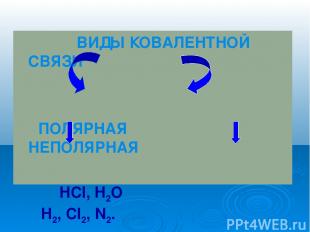
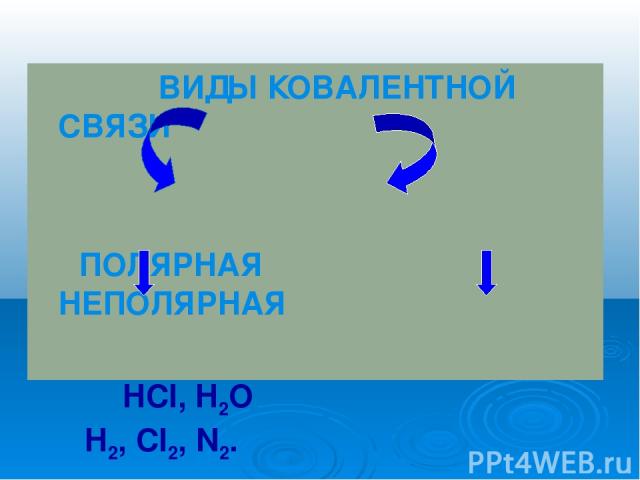
ВИДЫ КОВАЛЕНТНОЙ СВЯЗИ ПОЛЯРНАЯ НЕПОЛЯРНАЯ HCl, H2O H2, Cl2, N2.
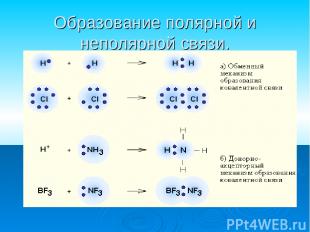
Образование полярной и неполярной связи.
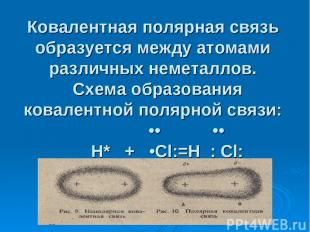
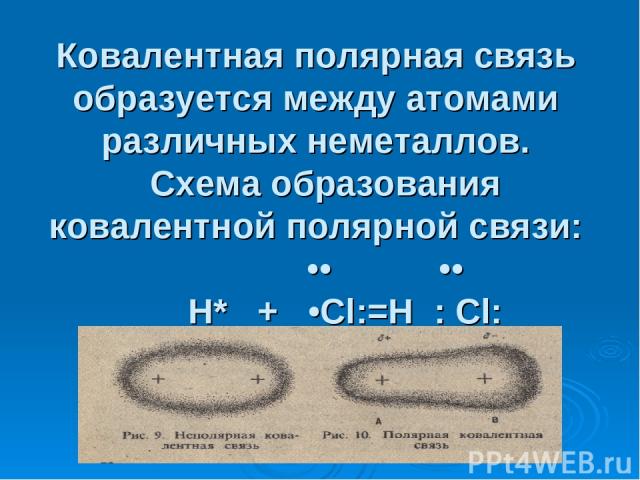
Ковалентная полярная связь образуется между атомами различных неметаллов. Схема образования ковалентной полярной связи: •• •• H* + •Cl:=H : Cl: •• ••

ВЕЩЕСТВА С АТОМНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ АЛМАЗ(С), КРЕМНИЙ (Si), КВАРЦ (SiO2). Они состоят из атомов, связанных друг с другом в бесконечный трехмерный каркас. Атомный каркас обладает высокой прочностью. Кристаллы твердые, тугоплавкие, без запаха, в воде нерастворимы.

ВЕЩЕСТВА С МОЛЕКУЛЯРНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ В УЗЛАХ – НАХОДЯТСЯ МОЛЕКУЛЫ. УДЕРЖИВАЮТСЯ СЛАБЫМИ МЕЖМОЛЕКУЛЯРНЫМИ СИЛАМИ. ВЕЩЕСТВА ЛЕГКОПЛАВКИ, ЧАСТО ИМЕЮТ ЗАПАХ. ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ ПРЕДСТАВЛЯЮТ СОБОЙ ЖИДКОСТИ (ВОДА,БРОМ), ГАЗЫ (КИСЛОРОД, АЗОТ) ИЛИ ЛЕГКОПЛАВКИЕ ТВЕРДЫЕ ВЕЩЕСТВА (ИОД, СЕРА)

ВОДОРОДНАЯ СВЯЗЬ вид химической связи типа А — Н...А — Н ,образуется в результате взаимодействия атома водорода, связанного ковалентной связью с электроотрицательным атомом А (N, O, S и др.).
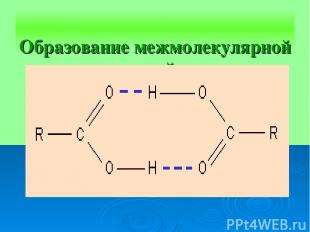
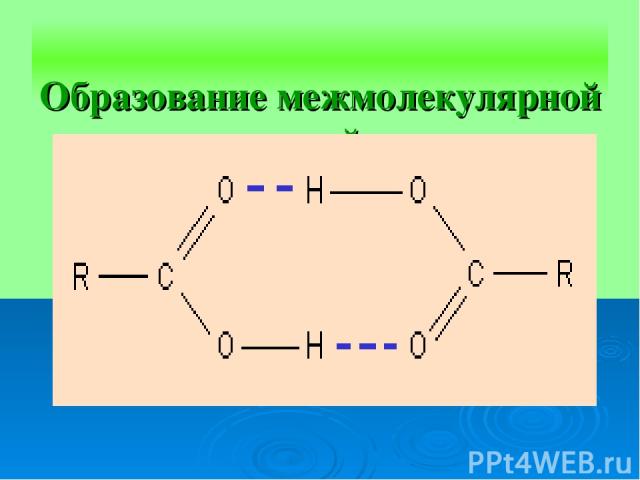
Образование межмолекулярной водородной связи.
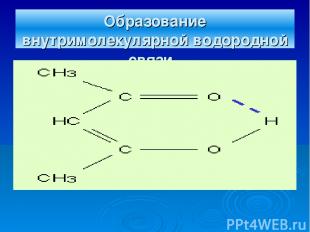
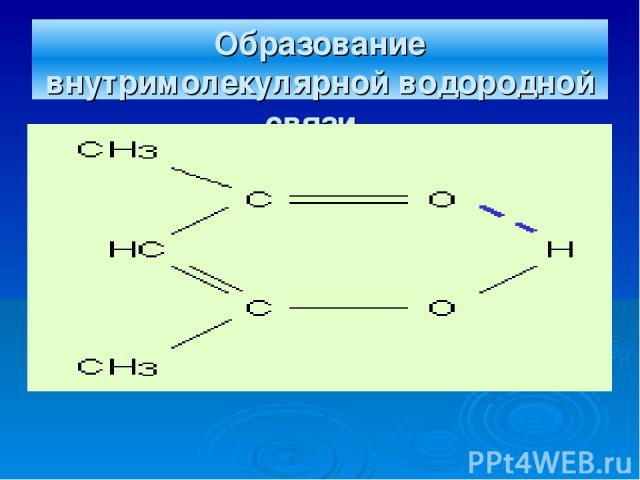
Образование внутримолекулярной водородной связи.

Механизм образования водородной связи имеет частично электростатический, частично донорно-акцепторный характер. Примеры межмолекулярной водородной связи: