Презентация на тему: Типы кристаллических решеток
Кристаллические решетки Николенко Т.П. Учитель химии МОУ «СОШ №5» г. Ивантеевка МО 900igr.net

Цели урока Сформировать понятия о кристаллическом и аморфном состоянии твердых тел Дать представления о типах кристаллических решеток Установить взаимосвязь между строением и свойствами веществ Дать представление о законе постоянства состава

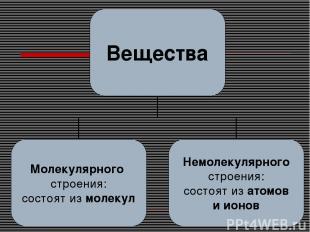
Вещество – то, из чего состоит физическое тело.


Аморфные вещества

Кристаллические вещества
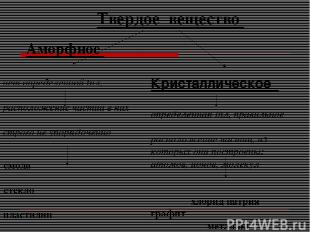
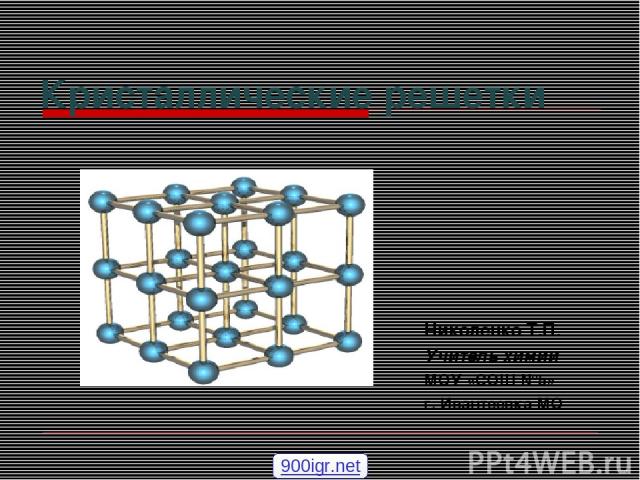
Твердое вещество Аморфное нет определенной tпл, расположение частиц в них строго не упорядоченно смола стекло пластилин воск пластмассы Кристаллическое определенная tпл, правильное расположение частиц, из которых они построены: атомов, ионов, молекул хлорид натрия графит металлы

Кристаллические решётки веществ-это упорядоченное расположение частиц (атомов, молекул, ионов) в строго определённых точках пространства. Точки размещения частиц называют узлами кристаллической решётки.

Вывод: Свойства веществ в твердом состоянии зависят от типа кристаллической решетки (прежде всего от того, какие частицы находятся в ее узлах).

Вывод: Строение атома ЭО Вид химической связи Тип кристаллической решетки Свойства веществ
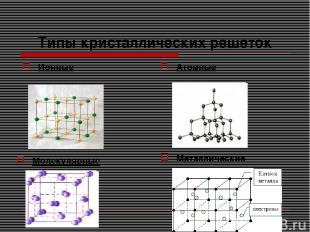
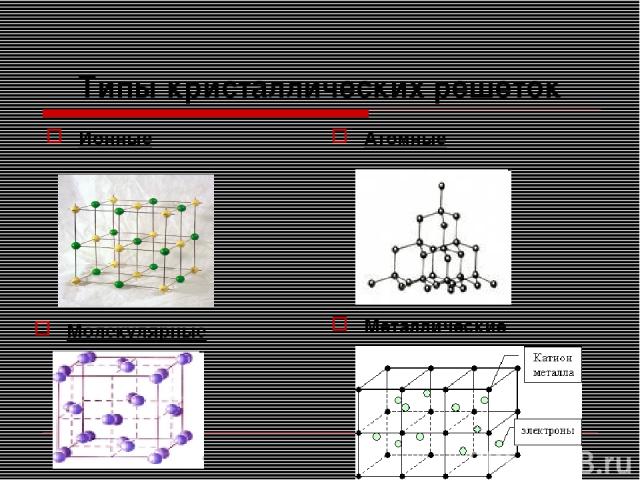
Типы кристаллических решеток Ионные Атомные Молекулярные Металлические
Кристаллические решетки, вид связи и свойства веществ Тип решетки Виды частиц в узлах решетки Вид связи между частицами Примеры веществ Физические свойства веществ Ионная Молекулярная Атомная Металлическая

Ионные кристаллические решетки Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов. Рассмотрим строение кристалла поваренной соли, в узлах которого находятся ионы хлора и натрия. Связи между ионами в кристалле очень прочные и устойчивые. Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи. Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью.

Атомные кристаллические решетки Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными связями. В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры плавления, обладают повышенной твёрдостью. Алмаз - самый твёрдый природный материал.

Металлические кристаллические решетки Металлическими называют решётки, в узлах которых находятся атомы и ионы металла. Для металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность

Молекулярные кристаллические решетки Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них ковалентные, как полярные, так и неполярные. Связи в молекулах прочные, но между молекулами связи не прочные. Вещества с МКР непрочные,имеют малую твёрдость, низкую температуру плавления,летучие,способны к возгонке при обычных условиях находятся в газообразном или жидком состоянии .
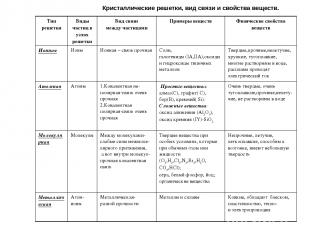
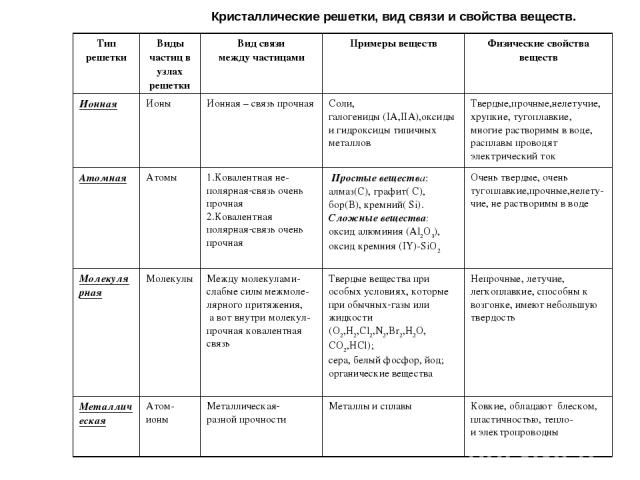
Кристаллические решетки, вид связи и свойства веществ. Тип решетки Виды частиц в узлах решетки Вид связи между частицами Примеры веществ Физические свойства веществ Ионная Ионы Ионная – связь прочная Соли, галогениды (IA,IIA),оксиды и гидроксиды типичных металлов Твердые,прочные,нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток Атомная Атомы 1.Ковалентная не- полярная связь очень прочная 2.Ковалентная полярная связь очень прочная Простые вещества: алмаз(C), графит( C), бор(B), кремний( Si). Сложные вещества: оксид алюминия (Al2O3), оксид кремния (IY)-SiO2 Очень твердые, очень тугоплавкие,прочные,нелету-чие, не растворимы в воде Молекулярная Молекулы Между молекулами- слабые силы межмоле- лярного притяжения, а вот внутри молекул- прочная ковалентная связь Твердые вещества при особых условиях, которые при обычных газы или жидкости (О2,Н2,Cl2,N2,Br2,H2O, CO2,HCl); сера, белый фосфор, йод; органические вещества Непрочные, летучие, легкоплавкие, способны к возгонке, имеют небольшую твердость Металлическая Атом-ионы Металлическая разной прочности Металлы и сплавы Ковкие, обладают блеском, пластичностью, тепло- и электропроводны

Вывод: Существует следующая закономерность: если известно строение веществ, то можно предсказать их свойства, или наоборот: если известны свойства веществ, то можно определить строение.
Закон постоянства состава Жозеф Луи Пруст. 1808 г. родился 26 сентября 1754 г. в небольшом городке Анжере в семье аптекаря 1775 г. он был назначен на должность управляющего аптекой больницы Сальпетриер 1777 г. Пруст получил приглашение на кафедру химии и металлургии недавно основанной Королевской семинарии в Вергаре (Испания) 1785 г. король Испании Карл III пригласил Пруста на должность профессора химии Артиллерийской школы в Сеговии В дальнейшем Пруст руководил кафедрами химии в университете Саламанки (1789), а затем Мадрида (1791–1808).

Вывод: химическая формула вещества заключает в себе большую информацию SO3: 1.Конкретное вещество серный газ, или оксид серы(VI). 2.Тип вещества сложное; класс оксид. 3. Качественный состав состоит из двух элементов: серы и кислорода. 4. Количественный состав молекула состоит из1 атома серы и 3 атомов кислорода. 5.Относительная молекулярная масса Mr(SO3)= 32 + 3 16 = 80 6. Молярная масса М(SO3) = 80 г/моль 7. Много другой информации

Зачеркните по вертикали, горизонтали, диагонали вещества, имеющие одинаковую кристаллическую решетку. NaCl N2O Mg(OH)2 CO2 K2S NH3 Cl2 O2 NaOH NaCl N2O Mg(OH)2 CO2 K2S NH3 Cl2 O2 NaOH

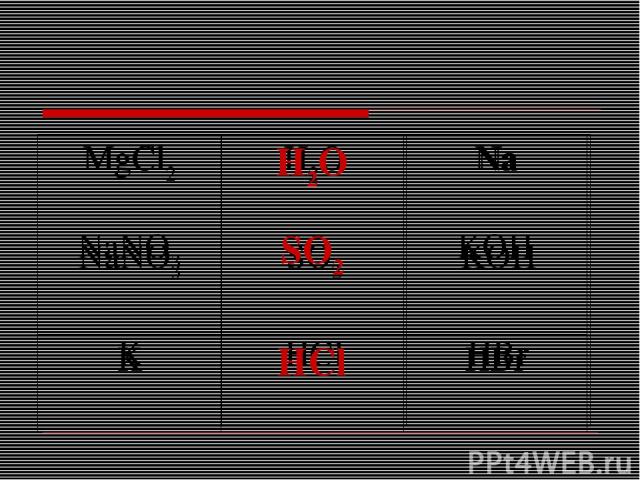
МgCl2 H2O Na NaNO3 SO2 KOH K HCl HBr МgCl2 H2O Na NaNO3 SO2 KOH K HCl HBr

Подведение итогов занятия Какие классификации веществ вы узнали? Как вы понимаете термин кристаллическая решетка. В каком агрегатном состоянии вещества имеют кристаллические решетки? Какие типы кристаллических решеток вы теперь знаете? О какой закономерности строения и свойств веществ вы узнали? С каким основным законом химии вы познакомились на уроке?