Презентация на тему: Типы и характеристики химических связей

900igr.net
Ковалентная связь Ионная связь Металлическая связь Водородная связь содержание
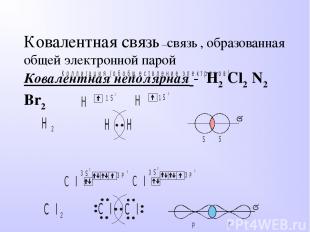
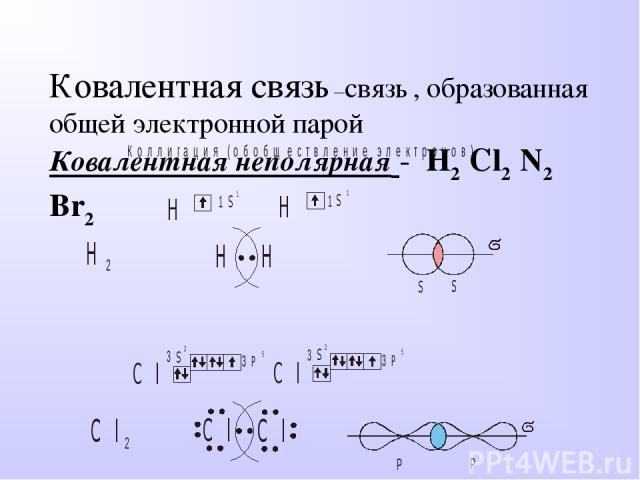
Ковалентная связь –связь , образованная общей электронной парой Ковалентная неполярная - H2 Cl2 N2 Br2

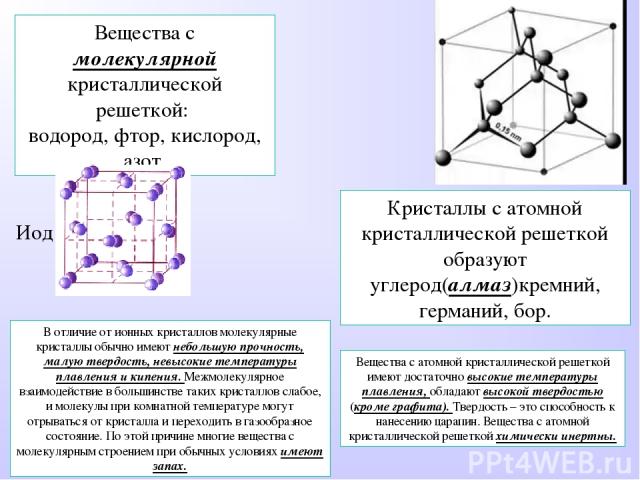
Свойства веществ с ковалентной неполярной связью: При обычных условиях вещества газообразные (водород, кислород), жидкие (бром), твердые (иод, фосфор). Большинство веществ сильнолетучие, т.е. имеют очень низкие температуры плавления и кипения. Растворы и расплавы веществ электрического тока не проводят. Вещества с молекулярной кристаллической решеткой: водород, фтор, кислород, азот. Кристаллы с атомной кристаллической решеткой образуют углерод(алмаз)кремний, германий, бор.
Вещества с молекулярной кристаллической решеткой: водород, фтор, кислород, азот. Иод Кристаллы с атомной кристаллической решеткой образуют углерод(алмаз)кремний, германий, бор. Вещества с атомной кристаллической решеткой имеют достаточно высокие температуры плавления, обладают высокой твердостью (кроме графита). Твердость – это способность к нанесению царапин. Вещества с атомной кристаллической решеткой химически инертны. В отличие от ионных кристаллов молекулярные кристаллы обычно имеют небольшую прочность, малую твердость, невысокие температуры плавления и кипения. Межмолекулярное взаимодействие в большинстве таких кристаллов слабое, и молекулы при комнатной температуре могут отрываться от кристалла и переходить в газообразное состояние. По этой причине многие вещества с молекулярным строением при обычных условиях имеют запах.
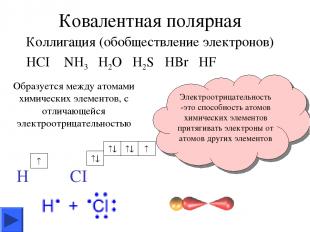
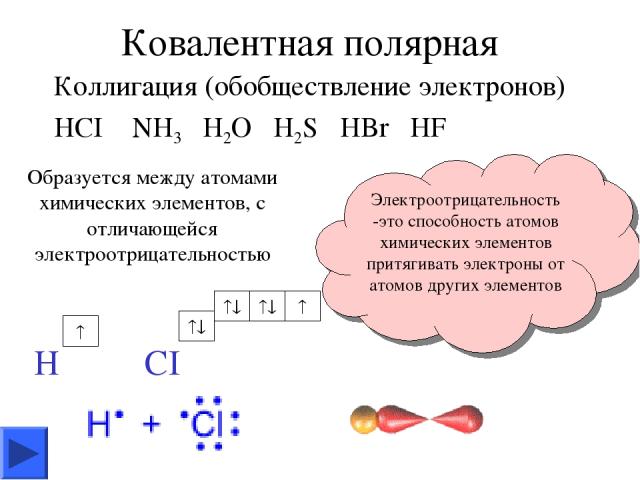
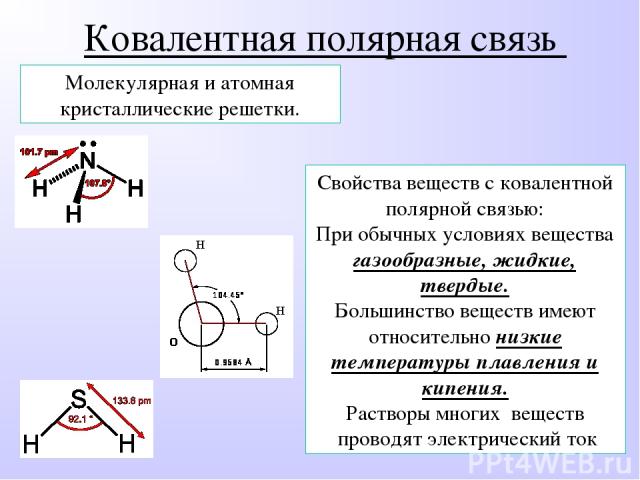
Ковалентная полярная Коллигация (обобществление электронов) HCI NH3 H2O H2S HBr HF Образуется между атомами химических элементов, с отличающейся электроотрицательностью Электроотрицательность -это способность атомов химических элементов притягивать электроны от атомов других элементов
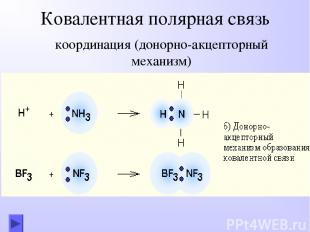
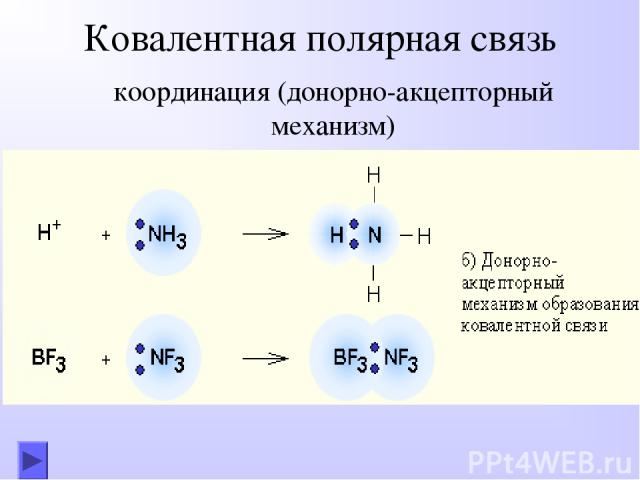
Ковалентная полярная связь координация (донорно-акцепторный механизм)
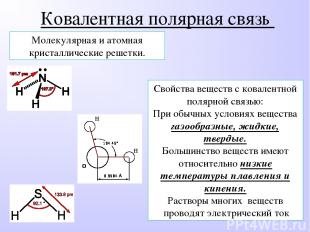
Свойства веществ с ковалентной полярной связью: При обычных условиях вещества газообразные, жидкие, твердые. Большинство веществ имеют относительно низкие температуры плавления и кипения. Растворы многих веществ проводят электрический ток Молекулярная и атомная кристаллические решетки. Ковалентная полярная связь

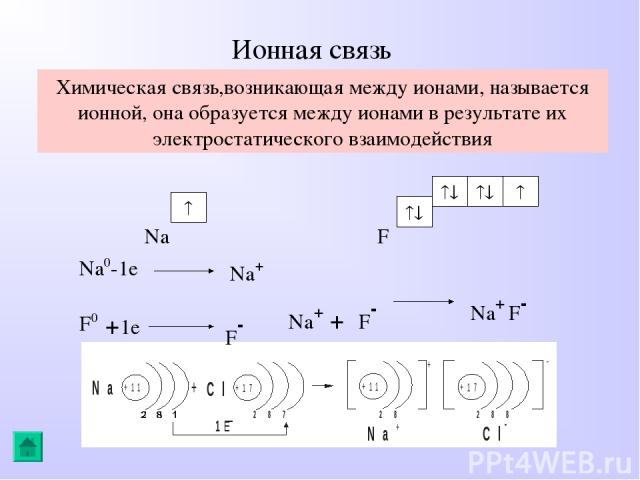
Ионная связь Химическая связь,возникающая между ионами, называется ионной, она образуется между ионами в результате их электростатического взаимодействия Na F Na0-1e Na+ F0 +1e F- Na+ + F- Na+ F-
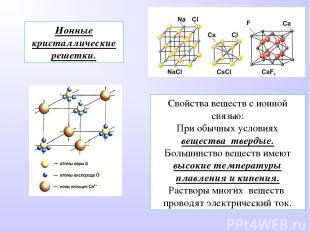
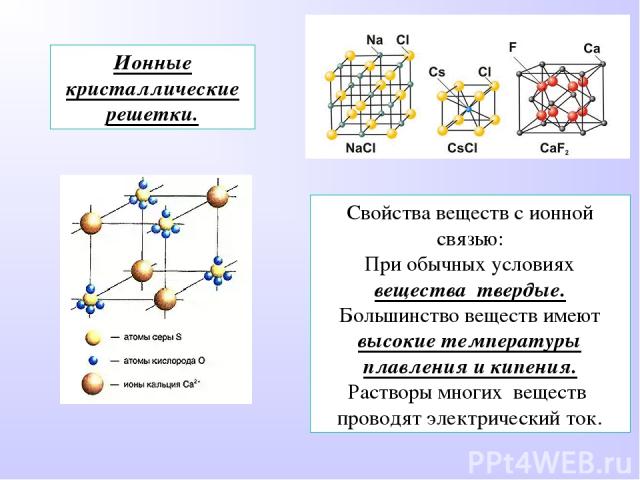
Ионные кристаллические решетки. Свойства веществ с ионной связью: При обычных условиях вещества твердые. Большинство веществ имеют высокие температуры плавления и кипения. Растворы многих веществ проводят электрический ток.
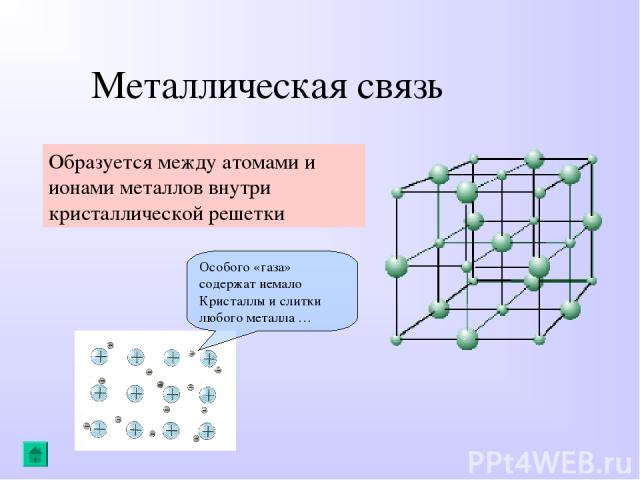
Металлическая связь Образуется между атомами и ионами металлов внутри кристаллической решетки Особого «газа» содержат немало Кристаллы и слитки любого металла …

Свойства веществ с металлической связью: высокая, электрическая проводимость, уменьшается с повышением температуры металла. высокая теплопроводность; пластичность, ковкость; характерный «металлический» блеск; широкие пределы изменения плотности, прочности, твердости, температуры плавления.
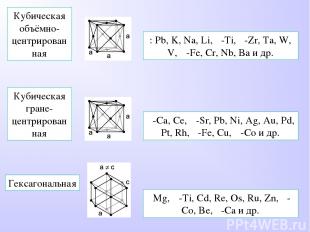
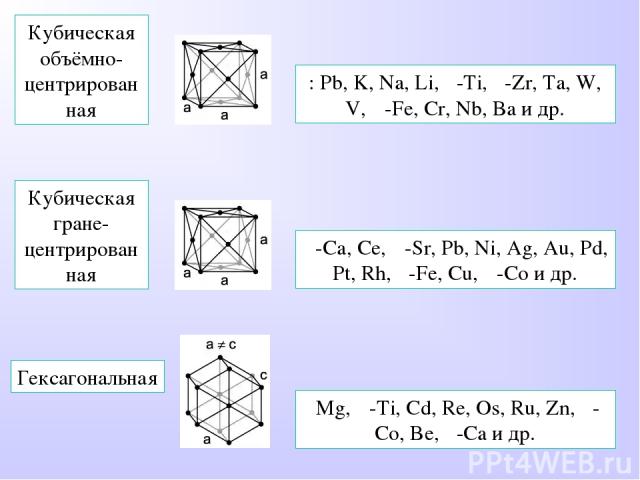
: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др. Кубическая объёмно-центрированная Кубическая гране-центрированная α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co и др. Гексагональная Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.

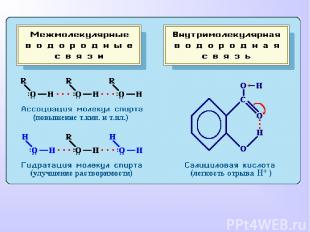
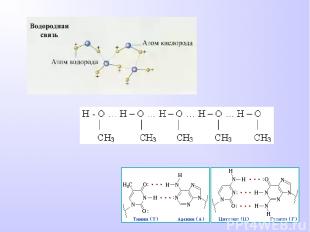
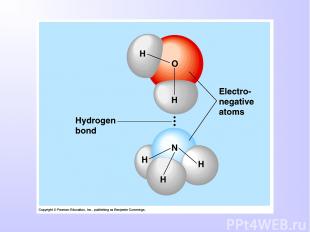
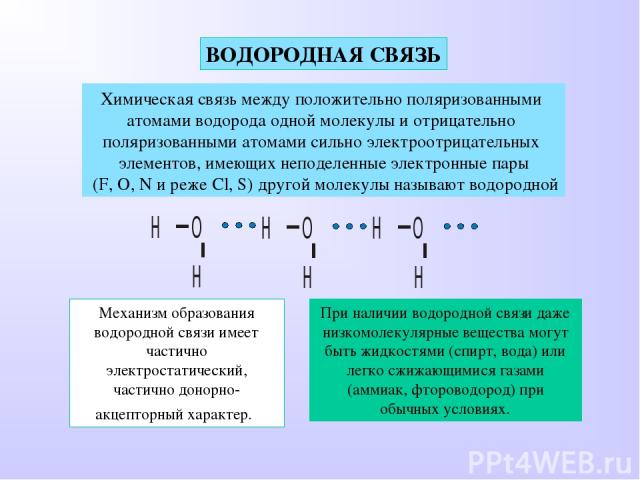
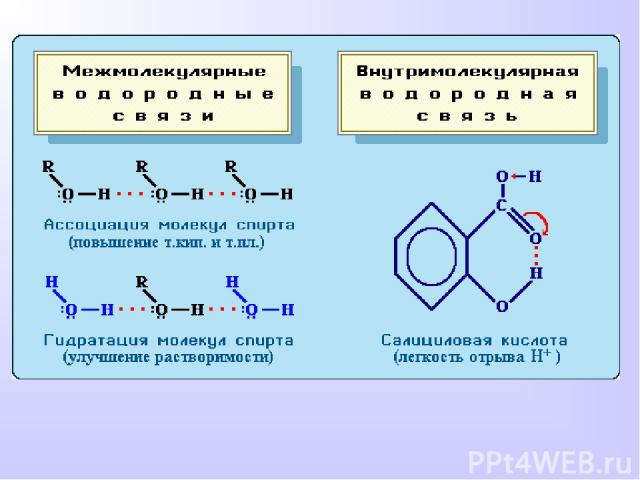
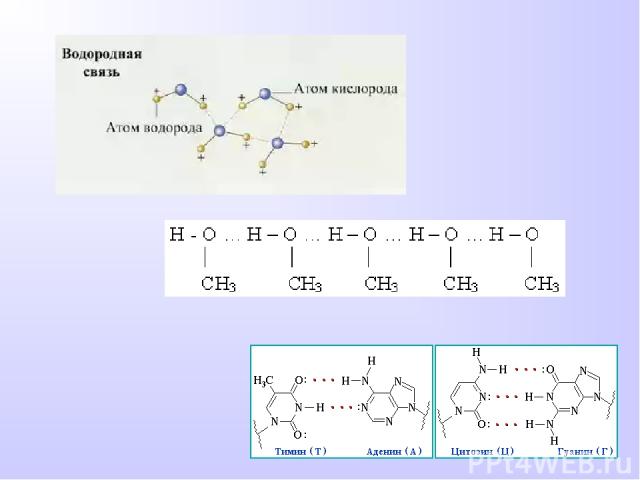
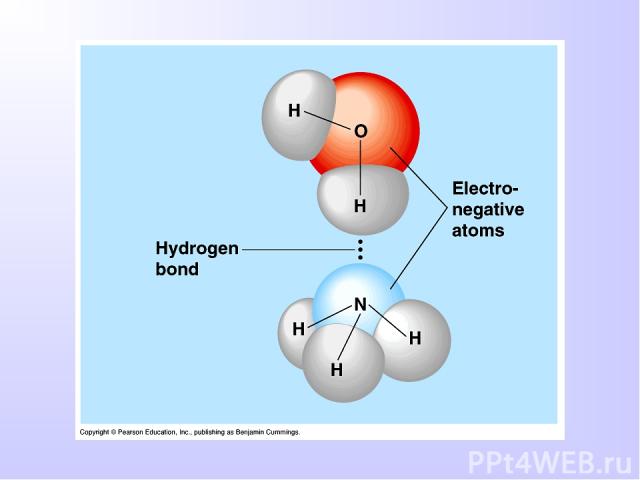
ВОДОРОДНАЯ СВЯЗЬ Химическая связь между положительно поляризованными атомами водорода одной молекулы и отрицательно поляризованными атомами сильно электроотрицательных элементов, имеющих неподеленные электронные пары (F, O, N и реже Cl, S) другой молекулы называют водородной Механизм образования водородной связи имеет частично электростатический, частично донорно-акцепторный характер. При наличии водородной связи даже низкомолекулярные вещества могут быть жидкостями (спирт, вода) или легко сжижающимися газами (аммиак, фтороводород) при обычных условиях.