Презентация на тему: Подготовка к ГИА-9 по

Prezentacii.com

Необходимо выбрать несколько правильных ответов из пяти предложенных и записать ответ в виде последовательности цифр

Проверка знаний по темам: Периодический закон Д.И. Менделеева Закономерности изменения свойств элементов и их соединение в связи с положением в периодической таблице

Cl Si Al: 1)уменьшаются заряды ядер атомов 2)возрастают кислотные свойства летучих водородных соединений 3)высшая степень окисления уменьшается 4)уменьшается радиус атомов 5)усиливаются металлические свойства

1)O – N - C 2)I – Br - Cl 3)Si – P - S 4)N – P - As 5) Si – B - Be
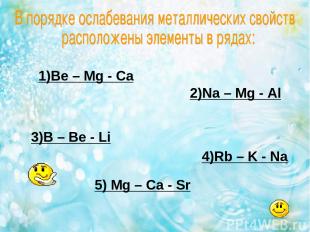
1)Be – Mg - Ca 2)Na – Mg - Al 3)B – Be - Li 4)Rb – K - Na 5) Mg – Ca - Sr

1)Be – Mg - Ca 2)Na – Mg - Al 3)B – Be - Li 4)Rb – K - Na 5) Mg – Ca - Sr

Be Mg Ba: 1)увеличивается степень окисления элементов в высших оксидах 2)увеличивается радиус атомов 3)увеличиваются заряды ядер атомов 4)уменьшается число неспаренных электронов на последнем уровне 5)усиливаются неметаллические свойства

Проверяются знания по темам: Первоначальные сведения об органических веществах

1)Составной частью природного газа 2)Вступает в реакцию с хлором 3)Хорошо растворяется в воде 4)Относится к непредельным углеводородам 5)Не реагирует с кислородом

Относится к ароматическим углеводородам 2) Реагирует с кислородом 3)В молекуле все связи одинарные 4)Обесцвечивает бромную воду 5)Характерны реакции замещения

1)Общая формула класса CnH2n-2 2)Обесцвечивает бромную воду 3)Хорошо растворяется в воде 4)Относится к предельным углеводородам 5)Не реагирует с кислородом

1)Жидкость с резким запахом 2)Нерастворим в воде 3) В составе содержится гидроксильная группа 4)Относится к непредельным соединения 5)Общая формула CnH2nO2

1)Изменяет окраску индикатора 2)Реагирует с оксидом углерода 3)Её формула СН3ОН 4) Не горит 5)Жидкость с резким запахом

Проверяются знания по темам: Окислительно-восстановительные реакции Окислитель, восстановитель Степень окисления элементов

Схема превращения А)3Cu+8HNO3= 3Cu(NO3) 3+2NO+4H2O Б)2NH3+3FeO=3Fe+N2+3H2O В)2NH3+2Na = 2NaNH2+H2 Свойства азота 1)Окислитель 2)Восстановитель 3)Ни окислитель, ни восстановитель 4)И окислитель, и восстановитель А Б В Ответ:

Реагенты А)S + O2 = Б)SO2 + O2 = В)Cu + H2SO4(конц) Изменение степени окисления 1)S+4 S+6 2) S0 S+4 3) S0 S+6 4) S0 S-2 5)S+6 S+4 А Б В Ответ:

Реагенты А)Cl2+K2MnO4 =KMnO4+KCl Б)NH4Cl+KNO3 =KCl+N2O+H2O В)HI+FeCl3=FeCl2+HCl+I2 Изменение степени окисления 1)Э+ 6 Э+7 2) Э +5 Э+1 3) Э +3 Э+2 4) Э0 Э-1 5)Э -1 Э0 А Б В Ответ:

Схема превращения А)HCl+MnO2=MnCl2+H2O+Cl2 Б) MnO2+H2O2+H2SO4= MnSO4+2H2O+O2 В)MnO2+H2SO4=MnSO4+2H2O+O2 Степень окисления восстановителя: 1)+4 2)-2 3)-1 4)+6 5)+2 А Б В Ответ:

Схема превращения А)5S+6NaOH=4Na2S+Na2SO3+3H2O Б)SO2+2H2S=3S+2H2O В)N2O5+SO2=SO3+2NO Свойства серы 1)Окислитель 2)Восстановитель 3)Ни окислитель, ни восстановитель 4)И окислитель, и восстановитель А Б В Ответ

Проверяются знания по темам: Химические свойства простых веществ Химические свойства сложных веществ

Вещество А)Азотная кислота Б)Хлор В)Сульфат меди (II) Реагенты 1)Al(OH) 3 Cu 2)O2 HCl 3)Mg H2 4)Ba(NO3) 2 NaOH А Б В Ответ:

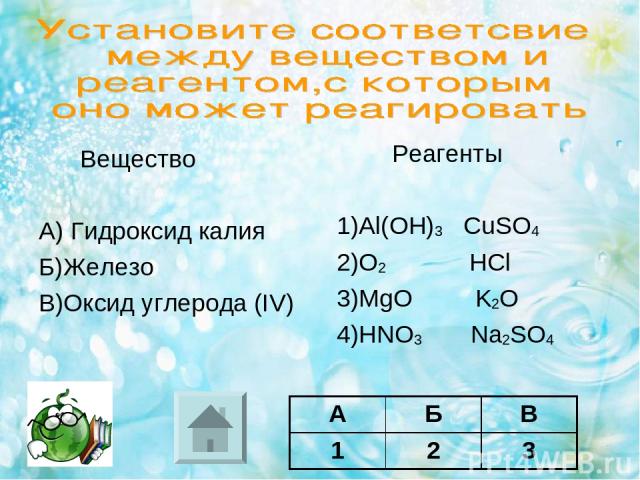
Вещество А) Гидроксид калия Б)Железо В)Оксид углерода (IV) Реагенты 1)Al(OH)3 CuSO4 2)O2 HCl 3)MgО K2O 4)HNO3 Na2SO4 А Б В Ответ:

Вещество А)S Б)H2SO4 В)Оксид азота (V) Реагенты 1)KOH K2O 2)O2 Fe 3)Mg K2O 4)HNO3 Na2SO4 А Б В Ответ:

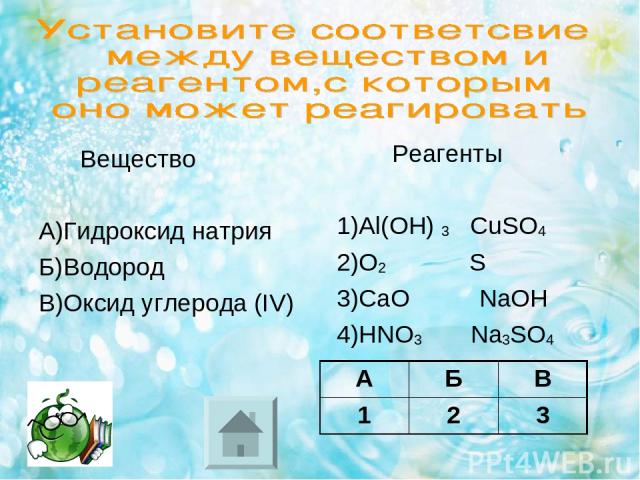
Вещество А)Гидроксид натрия Б)Водород В)Оксид углерода (IV) Реагенты 1)Al(OH) 3 CuSO3 2)O3 S 3)CaO NaOH 4)HNO3 Na3SO3 А Б В Ответ:

Реагенты А)H2SO4(конц)+Cu Б)H2SO4(разб)+Cu В)H2SO4(разб)+CuO Продукты 1)CuSO4+H2 2)CuSO4+H2O 3)CuSO4+H2O+SO2 4)Не взаимодействуют А Б В Ответ:


Источники: Литература: Р.Г.Иванова, А.А.Каверина,А.С.Корощенко. Химия. Сборник заданий для проведения экзамена в 9 классе. –М.:Просвещение,2006. В.Н.Доронькин, А.Г.Бережная,Т.В.Сажнева, В.А.Февралева Химия 9 класс. Подготовка к ГИА 2011.- Ростов н/ Д: Легион, 2010. Добротин Д.Ю., Каверина А.А., Гончарук О.Ю.ГИА. Химия.-Ярославль: Интеллект-Центр,2009. Интернет-источники: http://www.master-live.ru/gifimg/index2.htm http://allforchildren.ru/pictures/school21.php?page=4 http://tana.ucoz.ru/load/116 http://www.fipi.ru

Схема превращения А)Cu+HNO3= Cu(NO3) 3+NO+H2O Б)NH3+FeO=Fe+N2+H2O В)NH3+Na = NaNH2+H2 Свойства азота 1)Окислитель 2)Восстановитель 3)Ни окислитель, ни восстановитель 4)И окислитель, и восстановитель А Б В 1 2 2

Реагенты А)S + O2 = Б)SO2 + O2 = В)Cu + H2SO4(конц) Изменение степени окисления 1)S+4 S+6 2) S0 S+4 3) S0 S+6 4) S0 S-2 5)S+6 S+4 А Б В 2 3 5

Реагенты А)Cl2+K2MnO4 =KMnO4+KCl Б)NH4Cl+KNO3 =KCl+N2O+H2O В)HI+FeCl3=FeCl2+HCl+I2 Изменение степени окисления 1)Э+6 Э+7 2) Э +5 Э+1 3) Э +3 Э+2 4) Э0 Э-1 5)Э -1 Э0 А Б В 4 2 5

Схема превращения А)HCl+MnO2=MnCl2+H2O+Cl2 Б) MnO2+H2O2+H2SO4= MnSO4+2H2O+O2 В) MnO2+H2SO4=MnSO4+2H2O+O2 Степень окисления восстановителя: 1)+4 2)-2 3)-1 4)+6 5)+2 А Б В 3 1 1

Схема превращения А)5S+6NaOH=4Na2S+Na2SO3+3H2O Б)SO2+2H2S=3S+2H2O В)N2O5+SO2=SO3+2NO Свойства серы 1)Окислитель 2)Восстановитель 3)Ни окислитель, ни восстановитель 4)И окислитель, и восстановитель А Б В 4 4 2

Вещество А)Азотная кислота Б)Хлор В)Сульфат меди (II) Реагенты 1)Al(OH)3 Cu 2)O2 HCl 3)Mg H2 4)Ba(NO3)2 NaOH А Б В 1 3 4
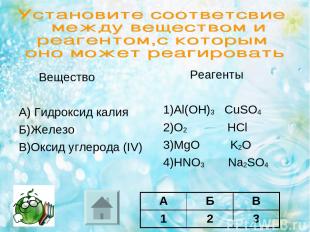
Вещество А) Гидроксид калия Б)Железо В)Оксид углерода (IV) Реагенты 1)Al(OH)3 CuSO4 2)O2 HCl 3)MgО K2O 4)HNO3 Na2SO4 А Б В 1 2 3

Вещество А)S Б)H2SO4 В)Оксид азота (V) Реагенты 1)KOH K2O 2)O2 Fe 3)Mg K2O 4)HNO3 Na2SO4 А Б В

Вещество А)Гидроксид натрия Б)Водород В)Оксид углерода (IV) Реагенты 1)Al(OH) 3 CuSO4 2)O2 S 3)CaO NaOH 4)HNO3 Na3SO4 А Б В 1 2 3

Реагенты А)H2SO4(конц)+Cu Б)H2SO4(разб)+Cu В)H2SO4(разб)+CuO Продукты 1)CuSO4+H2 2)CuSO4+H2O 3)CuSO4+H2O+SO2 4)Не взаимодействуют А Б В 3 4 2