Презентация на тему: Периодическая система элементов
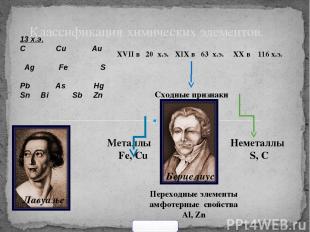
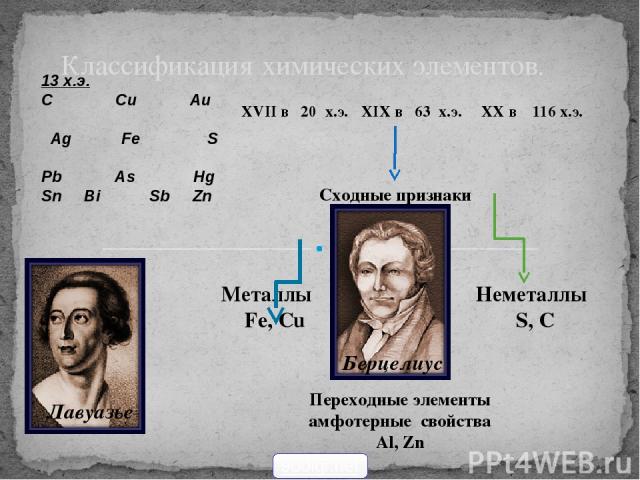
Классификация химических элементов. 13 х.э. С Сu Au Ag Fe S Pb As Hg Sn Bi Sb Zn XVII в 20 х.э. XIX в 63 х.э. XX в 116 х.э. Берцелиус Сходные признаки Лавуазье Металлы Fe, Cu Неметаллы S, C Переходные элементы амфотерные свойства Al, Zn 900igr.net

Попытки в систематике химических элементов (их было предпринято около 50) Триады И. Деберейнера (1829г.) Триада- тройка сходных элементов . Из известных в то время химических элементов И. Деберейнеру удалось выделить три триады: CI – Br – I K – Rb – Ba Ca – Sr - Te Ученый обнаружил, что атомный вес среднего элемента был близок среднему арифметическому атомных весов сходным с ним по химическим свойствам двух других крайних элементов.

«Закон октав» (1865 г.) Английский химик Дж.Ньюлендс . Расположил известные Х.Э. в порядке увеличения их атомных масс и даже приписал каждому Х.Э. определенный «порядковый номер», в этом ряду через одинаковые интервалы находятся элементы, сходные по своим химическим свойствам, восьмой по счёту элемент повторяет свойства первого, подобно повторению звуковв музыкальной октаве (номера аналогичных элементов, как правило, отличаются на целое число 7). H Li Be B C N O F Na Mg AI Si P S CI K Ca Cr Ti Mn Fe

Немецкий ученый Мейер (1864 г.) Опубликовал таблицу химических элементов, в которой расположил некоторые элементы по их валентности на 16 групп. В ней были правильно отображены некоторые их естественные семейства, однако из них не вытекало никакой общей закономерности. В таблице отсутствовали H, B,AI и некоторые другие элементы.

Итак, ни одна из попыток классифицировать х.э. не привела к созданию естественной системы, охватывающей все химические элементы и отражающей природу их сходства и различия. Решение этой задачи оказалось доступно лишь нашему соотечественнику Д.И.Менделееву, великому гражданину и ученому. В основу классификации положил фундаментальную характеристику элементов – атомную массу. «По смыслу всех точных сведений о явлении природы, писал он, - масса вещества есть именно такое свойство его, от которого должны находиться в зависимости все остальные свойства… Поэтому ближе всего и естественнее всего искать зависимости между свойствами и сходствами элементов, с одной стороны, и их атомными весами с другой».

Естественные семейства химических элементов Семейство щелочные металлы Li Na K Rb Cs Мягкие, легко окисляются кислородом воздуха, хранят под слоем керосина В=I R₂O - оксиды Семейство щелочнозе-мельные металлы Mg Ca Sr Ba «Землями» в средние века назывались природные минералы, содержащие оксиды металлов В = II RО - оксиды Семейство галогены F F ₂ Cl Cl₂ Br Br₂ I I₂ «Соли рождающие» Все галогены ядовиты! В = VII R₂O₇ оксиды B = I HCI летучие водородные соединения Семейство халькогены O S Se Te «Рождающие руды» В = VI RO₃ оксиды В = II H₂R летучие водородные соединения Менее активные неметаллы

Семейство инертных (благородных) газов конец XIX в Воздух Легкие He Ne Ar Тяжелые Kr Xe Rn Естественные семейства химических элементов

Мир сложен Он полон событий, сомнений, И тайн бесконечных, и смелых догадок, Как чудо природы, является гений И в хаосе этом находит порядок… Весь мир большой, Жара и стужа, Планет круженье, свет зари - Всё то, что видим мы снаружи, Законом связано внутри. Найдется ль правило простое, что целый мир объединит? Таблицу Менделеев строит, Природы ищет алфавит…

Атомные массы многих элементов, в то время, были определены неточно; Д.И.Менделеев изменил атомный вес у 20 х.э. ( Ar(Ве)=13.5, действительно Аr(Ве) = 9); Ряд элементов не был открыт – оставлены пустые клетки («экаалюминий» - Ga,«экабор» -Sc,«экасилиций -Ge»); Неточное определение положения х.э. в системе (руководствовался химическими свойствами. Например: йод теллур, кобальт никель, аргон криптон). Трудности открытия:

35 лет (17 ребёнок в семье) 1 марта 1869 г. Санкт- Петербург Атомная масса и валентность – основные характеристики х.э. Периодичность Формулировка периодического закона Д.И.Менделеева: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомных весов элементов» – закон природы. Периодическая система- графическое изображение периодического закона. Периодический закон химических элементов

I период начинается водородом Н и заканчивается гелием Не; IV период начинается калием К и заканчивается криптоном Kr; III период начинается натрием Na и заканчивается аргоном Аr; VII период начинается францием Fr - незакончен. Определить, какими х.э. начинается и заканчивается: I период, IV период, III период и VII период?

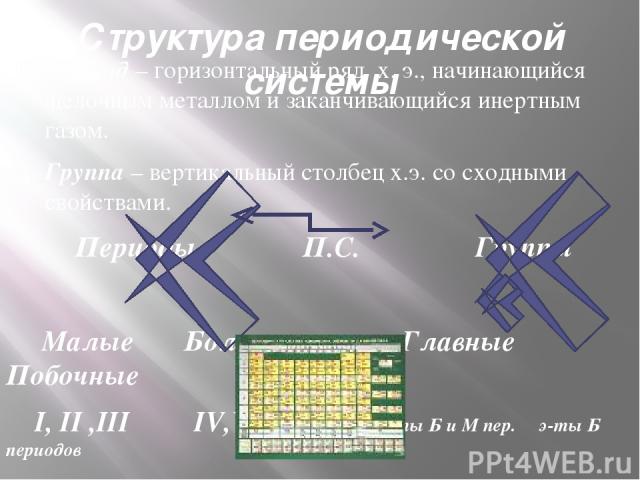
Структура периодической системы Период – горизонтальный ряд х. э., начинающийся щелочным металлом и заканчивающийся инертным газом. Группа – вертикальный столбец х.э. со сходными свойствами. Периоды П.С. Группы Малые Большие Главные Побочные I, II ,III IV,V,VI э-ты Б и М пер. э-ты Б периодов

«ГОРИЗОНТАЛЬНОЕ СТРОЕНИЕ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ» Периоды I-VII

Выводы по периоду: Слева Ar увеличивается относительная атомная масса; Слева металлические свойства ослабевают, а неметаллические свойства возрастают (щелочные металлы неметаллы инертные газы).

Группы I - VIII «ВЕРТИКАЛЬНОЕ СТРОЕНИЕ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ»

Выводы по группе: