Презентация на тему: Основания

Тема: Основания

Повторение 1. Дать определение оксидам 2. Классификация оксидов 3.Как дается название оксидов? CaO, Na2O, СО2, SO3, N2O5 4.Способы получения оксидов 5.Какие химические свойства характерны для: -кислотных оксидов -основных оксидов

Цель урока: 1. Познакомить учащихся с новым классом неорганических соединений – основаниями. 2. Рассмотреть классификацию, состав и номенклатуру оснований. 3.Химические свойства и получение оснований.

Основания – это сложные вещества, состоящие из металлов и связанных с ними одного или нескольких гидроксид-ионов.

Схема образования гидроксида натрия:

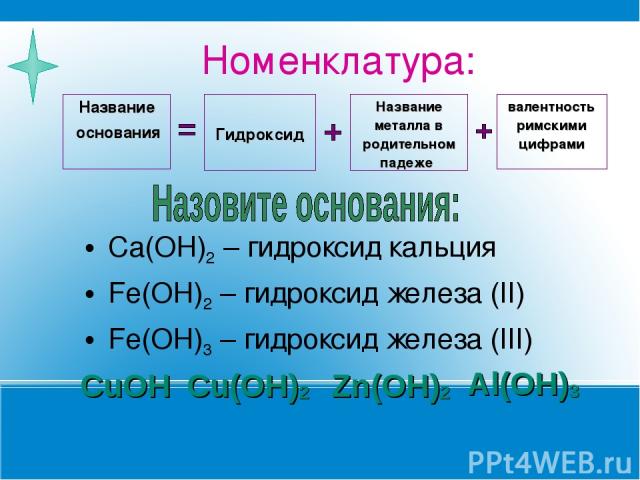
Номенклатура: Ca(OH)2 – гидроксид кальция Fe(OH)2 – гидроксид железа (II) Fe(OH)3 – гидроксид железа (III) Zn(OH)2 Al(OH)3 Cu(OH)2 CuOH Название металла в родительном падеже валентность римскими цифрами Название основания Гидроксид

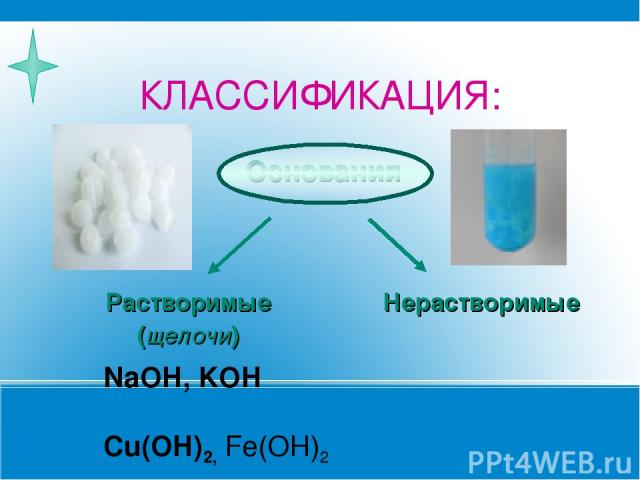
КЛАССИФИКАЦИЯ: NaOH, KOH Cu(OH)2, Fe(OH)2 Основания Растворимые (щелочи) Нерастворимые

Получение 1.Расстворимые в воде основания -щелочи А) активный металл + вода 2Na + 2НOH = 2NaOH +Н2 Б)основной оксид + вода СаО + Н2О = Са(ОН)2 В) электролиз растворов хлоридов активных металлов 2. Нерастворимые в воде основания Соль+основание FeCL3 +3 NaOH=Fe(OH)3↓+3NaCL CuSO4 + 2NaOH = Cu(OH)2) ↓ + Na2SO4

Физические свойства щелочей Гидроксиды щелочных металлов (едкие щёлочи) представляют собой твердые, белые, очень гигроскопичные вещества. Щёлочи — сильные основания, очень хорошо растворимые в воде, причём реакция сопровождается значительным тепловыделением. Сила основания и растворимость в воде возрастает с увеличением радиуса катиона в каждой группе периодической системы. Кроме того, едкие щёлочи растворимы в этаноле и метаноле.

Качественные реакции для щелочей малиновый бесцветный Фенолфталеин жёлтый оранжевый Метиловый оранжевый синий фиолетовый Лакмус Щелочная среда Нейтральная среда Индикатор Индикаторы – вещества под действием других веществ изменяют окраску.

Химические свойства 1.С кислотами Основание + кислота = Соли + вода NaOH + HCl = NaCl + H2O Реакцию между кислотой и основанием, в результате которой образуется соль и вода, называются реакциями нейтрализации 2. С солями Щёлочь + соли = (новое)основание + (новая) соль. Ba(OH)2 + Na2SO4 = BaSO4+ 2NaOH 3.Слабые основания при нагреве разлагаются: Cu(OH)2= CuO + H2O

4. С кислотными оксидами Щёлочь + кислотный оксид = соль + вода (р-ция обмена) Ca(OH)2 + CO2 = CaCO3 + H2O Р2О5 + 6КОН = 2К3РО4 + 3Н2О

Закрепление 1. Что такое основание? 2. Какими по растворимости бывают основания? 3. Каким оксидам соответствуют основания? 4. Составить основания и назвать: K2O, BaO, Cr2O3. 5. Составить оксиды и назвать: LiOH, Ca(OH)2.

Установите соответствие

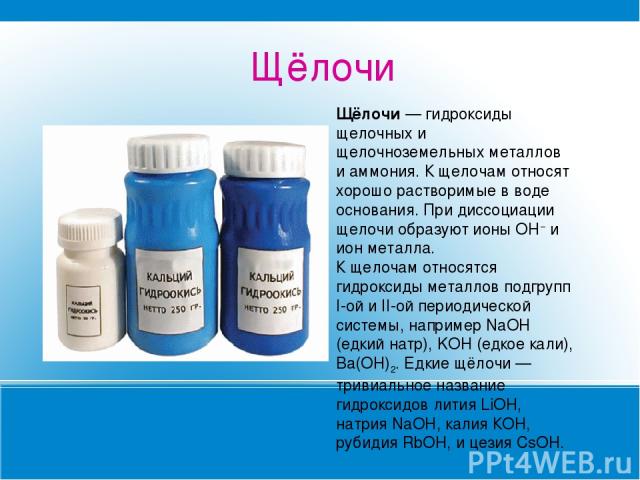
Щёлочи Щёлочи — гидроксиды щелочных и щелочноземельных металлов и аммония. К щелочам относят хорошо растворимые в воде основания. При диссоциации щелочи образуют ионы OH− и ион металла. К щелочам относятся гидроксиды металлов подгрупп I-ой и II-ой периодической системы, например NaOH (едкий натр), KOH (едкое кали), Ba(OH)2. Едкие щёлочи — тривиальное название гидроксидов лития LiOH, натрия NaOH, калия КОН, рубидия RbOH, и цезия CsOH.

Применение С. 98 параграф 31

ДОМАШНЕЕ ЗАДАНИЕ §31, упр.1,6 с.99