Презентация на тему: Молекулярная концентрация. Расчетные задачи

Молекулярная концентрация Расчетные задачи

Определения Концентрация - это содержание растворенного вещества в определенном количестве или объеме раствора. Массовая доля растворенного вещества (w) выражается в долях единицы и показывает массу растворенного вещества в определенной массе раствора. Это определение выражается формулой w = m1/m2, где w -- массовая доля растворенного вещества, m1 - масса растворенного вещества, m2 - масса раствора. Массовая доля растворенного вещества, выраженная в % , (w%), называется массовой процентной концентрацией.

Примеры задач: Задача 1 Задача 2 Задача 3 Задача 4 Задача 5

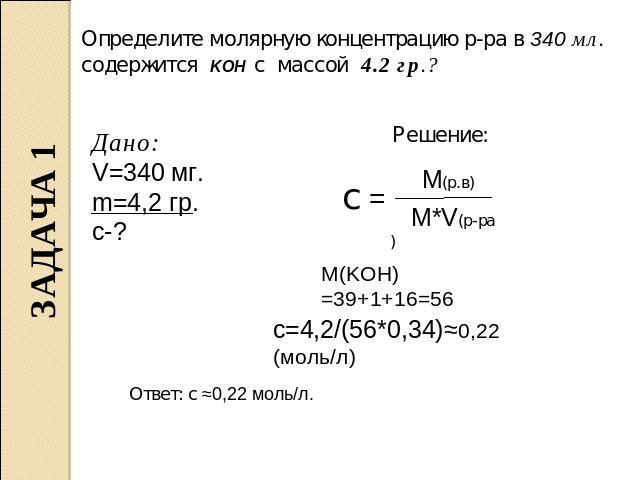
Определите молярную концентрацию р-ра в 340 мл. содержится KOH с массой 4.2 гр.? Дано: V=340 мг. m=4,2 гр. с-? Решение: M(KOH)=39+1+16=56 c=4,2/(56*0,34)≈0,22 (моль/л) Ответ: с ≈0,22 моль/л.
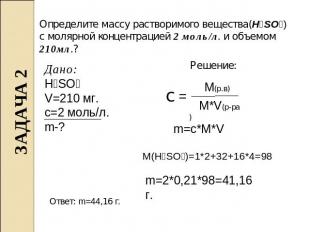
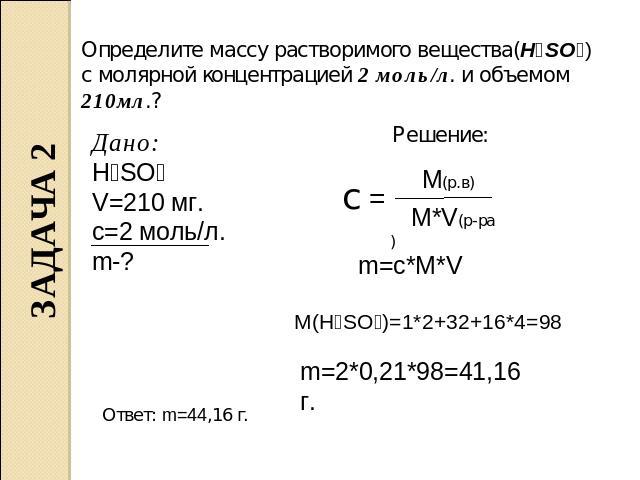
Определите массу растворимого вещества(H₂SO₄) с молярной концентрацией 2 моль/л. и объемом 210мл.? Дано: H₂SO₄ V=210 мг. c=2 моль/л. m-? Решение: m=c*M*V M(H₂SO₄)=1*2+32+16*4=98 m=2*0,21*98=41,16 г. Ответ: m=44,16 г.

Какое количество молекул сероводорода содержится в 23 мг. Раствора с молярной концентрацией 1,3 моль/л.? Дано: V=23 мг. C=1,3 моль/л. Nª=6*10²² m-? Решение: n=c*V n=1,3*0,23=0,299 моль. N=n*Nª N=0,299*6*10²³=1,794*10²³

Вычислите молярную концентрацию NaOH в растворе с массовой долей 24% и плотность 0,9 г/мл. Дано: ω= 0,2,ρ= 1220 г/л,М(NaOH) = 40 г/моль. c = ? Решение: m(р-ра)• ω = с•V•М(NaOH), m(р-ра)• ω = с•m(р-ра)•М(NaOH)/ ρ. Разделим обе части уравнения на m(р-ра) и подставим численные значения величин. 0,2 = c•40/1220. Отсюда c = 6,1 моль/л.

Повышенной сложности. Реши сам: Определите объем HCL с массовой долей 87%, плотностью 1,3г/мл. для приготовления соляной кислоты с массовой долей 47% ,с объемом 1л. и плотностью 1,20 г/мл. Дано: ω₁=87% ρ ₁ =1,3г/мл. ω₂=47% ρ ₂=1,20г/мл. V ₂ =1 л. V ₁(HCL)-?