Презентация на тему: Молекулярная физика и основы термодинамики

Лекции по физике. Молекулярная физика и основы термодинамики Основные газовые законы. Идеальный газ. Кинетическая теория газов

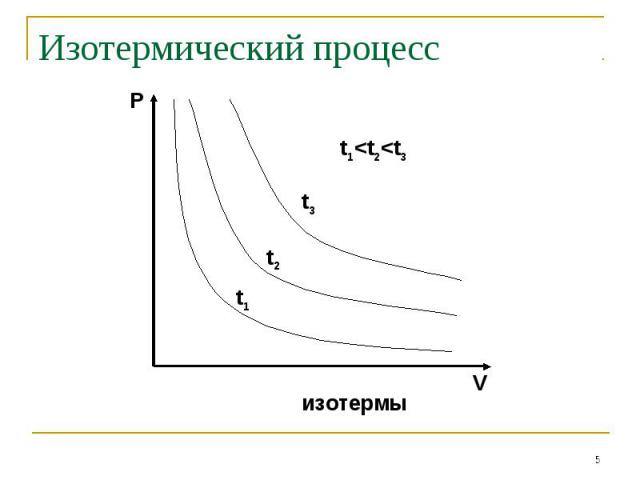
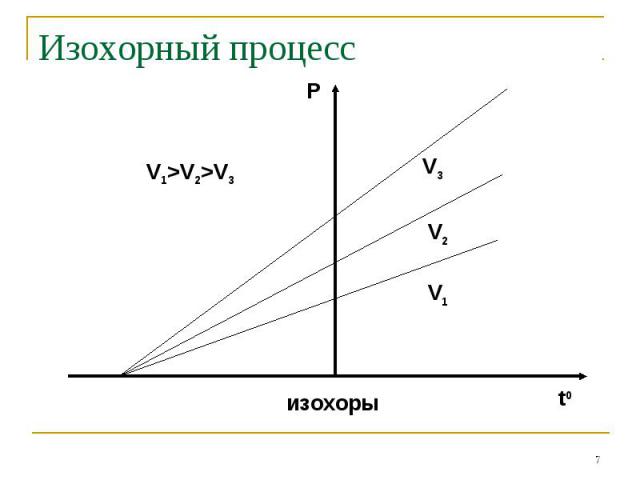
Основные газовые законы Закон Дальтона: Закон Бойля-Мариотта: PV=const при t0=constЗакон Шарля: P/T=const при V=constЗакон Гей-Люссака: V/T=const при P=constЗакон Авогадро: одинаковые количества газов при одинаковых температуре и давлении занимают одинаковый объём

Основные газовые законы Законы Шарля и Гей-Люссака имеют такой простой вид если температура измеряется по абсолютной шкалеПервоначально эти законы были сформулированы для температуры, измеренной в некоторой практической шкале. В этом случае они имеют более сложный вид:P=P0[1+(t-t0)]V=V0[1+(t-t0)]при чём коэффициенты и оказались равными и не зависящими от рода газа

Основные газовые законы Процессы, описываемые уравнениями 2-4 называются изопроцессами:ИзотермическимИзохорнымИзобарным
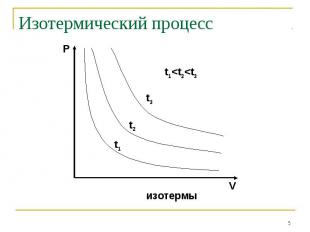
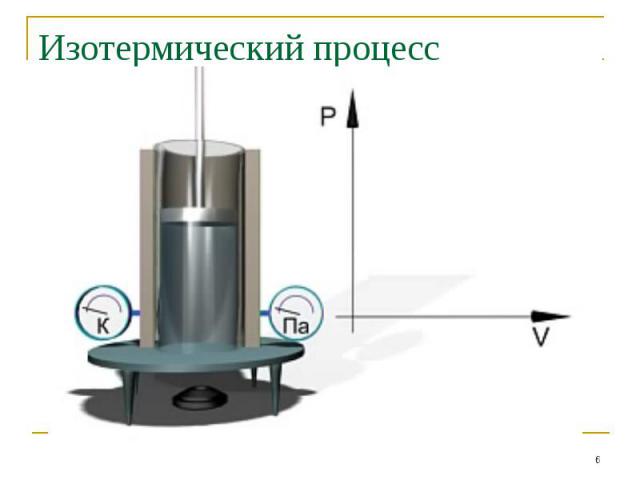
Изотермический процесс
Изотермический процесс
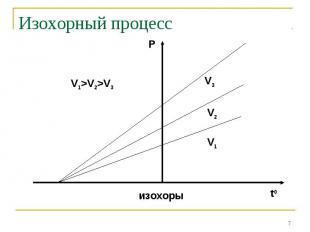
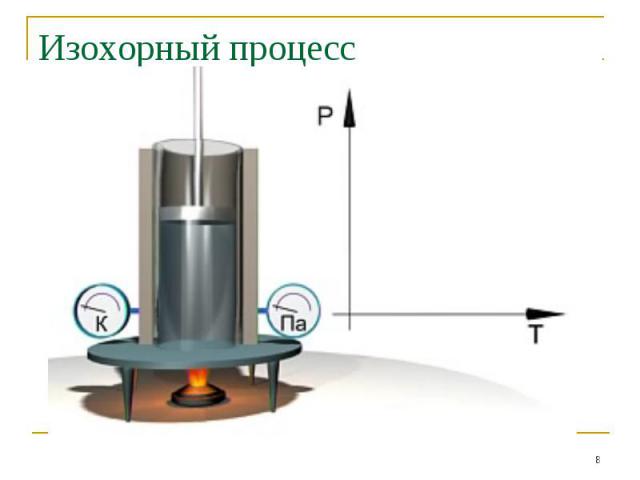
Изохорный процесс
Изохорный процесс
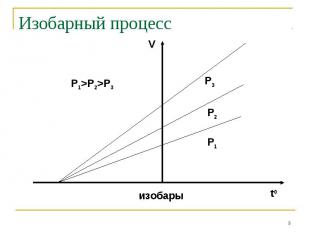
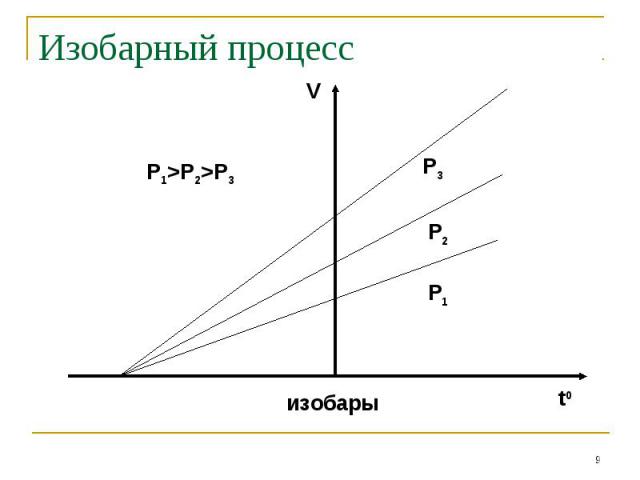
Изобарный процесс
Изобарный процесс

Основные газовые законы Если измерять температуру по шкале Цельсия, то оказывается, что точка пересечения изохорного и изобарного процессов с осью температур имеет координату t=-373,15 0С. Это значит, что ==1/273,15 1/0С

Основные газовые законы Если ввести новую шкалу температур, такую, что Т=t+273,15, то уравнения примут более простой вид:P/T=constV/T=constОпределённая таким образом температура называется абсолютной температурой
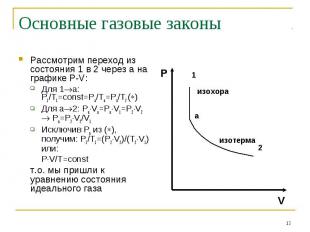
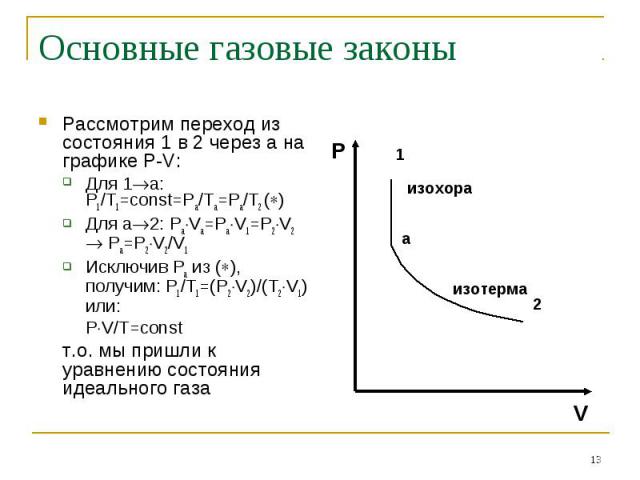
Основные газовые законы Рассмотрим переход из состояния 1 в 2 через а на графике P-V:Для 1а: P1/T1=const=Pa/Ta=Pa/T2 ()Для а2: PaVa=PaV1=P2V2 Pa=P2V2/V1Исключив Ра из (), получим: P1/T1=(P2V2)/(T2V1) или:PV/T=constт.о. мы пришли к уравнению состояния идеального газа

Основные газовые законы Из закона Авогадро следует, что величина соотношения (PV)/T не зависит от вида газа, значит мы можем записать, что для одного моля любого газа (PV)/T=R, где R – универсальная газовая постоянная, называемая постоянной АвогадроR=8,31 Дж/(градмоль)Из закона Дальтона следует, что при постоянных V и Т, Р является линейной функцией количества вещества

Основные газовые законы Т.о., мы пришли к уравнению Клапейрона-Менделеева:PV=RTили PV=(m/)RT

Основные газовые законы Идеальный газИдеальным называется такой газ, который подчиняется закону Клапейрона-МенделееваПоведение реальных газов приближается к поведению идеального газа в пределе низких давлений и высоких температурРазмеры молекул идеального газа малы по сравнению с межмолекулярным расстоянием, а энергией взаимодействия молекул можно пренебречь

Кинетическая теория газов Оценка размеров молекулСредний размер молекул <d>=(V/N)1/3, где V – объём, а N – количество молекулДля воды: =1г/см3, =18 г/моль V=18 см3. <d>=(V/NA)1/3=(18/61023)1/3310-8 см==310-10 м

Кинетическая теория газов Оценка расстояния между молекулами в газе<>=(V/NA)1/3, при комнатной температуре и атмосферном давлении 1 моль газа занимает объём 22 400 см3 <>=(22400/61023)1/33,310-7 смТ.о. <> на порядок больше, чем <d>, соответственно, объём на три порядка больше

Кинетическая теория газов Оценка средней длины свободного пробега молекул в газах<>(<>/<d>)2При нормальном давлении 10-5 см, то есть на два порядка больше <>

Кинетическая теория газов Задача МКТ заключается в установлении взаимосвязи между макроскопическими параметрами ТД системы (P, T и др.) и её микроскопическими характеристиками (, , <v>, <d>, <>)

Вывод основного уравнения МКТ Рассмотрим цилиндр с площадью основания S=1, опирающийся на стенку сосудаПримем следующую модельЧастицы разделены на три равные группы, каждая из которых движется вдоль одной из координатных осейЧастицы не взаимодействуют между собойПри ударе частицы о стенку, на неё действует сила <f>i такая, что: <f>i=pix2 pix()

Вывод основного уравнения МКТ Число ударов о стенку: zi=SnivixtЗаменим в () <f>i на <<f>> так, что <f>i=<<f>> tТогда, полная сила, действующая на стенку со стороны молекул, имеющих скорость vix:Fix=zi2 pix/t=Snivix pix

Вывод основного уравнения МКТ P=Fi/S=nivix pix=n<vx px>=1/3n<vp>=(2/3)n<Ek>Таким образом мы получили основное уравнение молекулярно-кинетической теории газов:Р=(2/3)n<Ek>

Оценка скорости молекул Р=(2/3)n<Ek>=(2/3)nm<v2>/2==Nm<v2>/(3V)=M<v2>/(3V) <v2>=3PV/M=3P/

Оценка скорости молекул Для молекул водорода Н2 =210-3 кг/моль,при комнатной температуре: <v>1800 м/сдля молекул О2 =210-3 кг/моль, при комнатной температуре:<v>500 м/с

Кинетическая теория газов Сравнивая уравнение Клапейрона-Менделеева: P=RT/V, где /V=n/Na с основным уравнением молекулярно-кинетической теории газов: Р=(2/3)n<Ek> мы можем заключить что: RT/NA=(2/3)<Ek>

Кинетическая теория газов Окончательно получаем: <Ek>=(3/2)kTгде k – постоянная Больцманаk=1,3810-23 Дж/градk=R/NAТ.о. мы выяснили молекулярно-кинетический смысл температуры – она пропорциональна средней кинетической энергии молекулы

Кинетическая теория газов Из Р=(2/3)n<Ek>и <Ek>=(3/2)kTследует что:P=nkT

Конец лекции