Презентация на тему: Минеральные удобрения для растений

Урок химии в 9 классе Тема «Минеральные удобрения» Учитель химии МОУ Никитовская СОШ Орлова О.Д. 900igr.net

«Сами, трудясь, вы многое сделаете для себя и близких. А если при труде успеха не будет, будет неудача, не беда – попробуйте еще, и тогда придет успех» Д.И.Менделеев

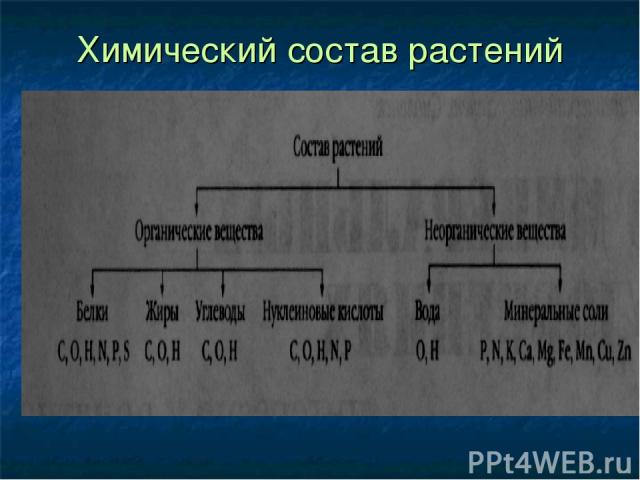
«Мозговой штурм» Какие вещества входят в состав растений?

Какие органические вещества вам известны?

Какие неорганические вещества содержатся в организме растений?

Из каких элементов состоят все упомянутые вещества?
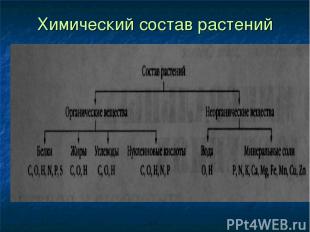
Химический состав растений

Откуда растения получают необходимые им элементы? Откуда в растение поступает углерод? Откуда растение может брать кислород и водород? Что является источником азота для растений?

Проблема: расход питательных веществ нужно восполнять, добавляя их в почву путем внесения удобрений. «Гораздо труднее увидеть проблему, чем найти ее решение» С. Бернар

Немецкий химик, академик. Один из основателей агрохимии. В 1840 г. предложил теорию минерального питания растений. На основе много численных анализов он установил, что каждому растению необходимо для нормальной жизнедеятельности 10 элементов: C, H, O, N, Ca, K, P, S, Mg, и Fe. Он также установил, что важнейшим из этих элементов являются три – N, K,P. Ю.Либих 1803-1873)

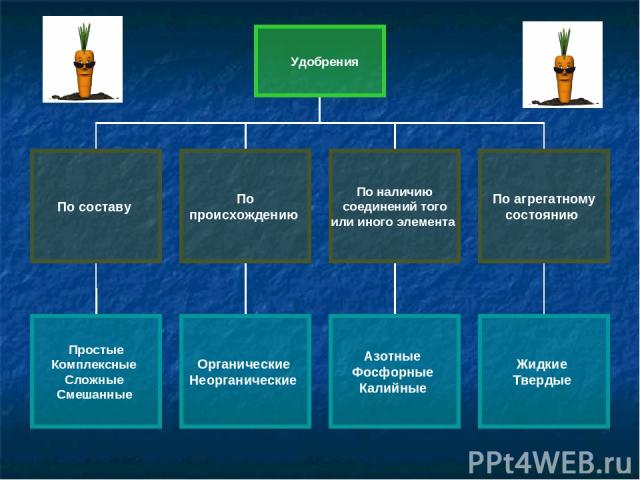
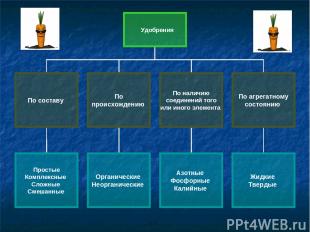
Цель: получить знания о составе и классификации минеральных удобрений. Добавляемые в почву органические и минеральные вещества, содержащие питательные элементы, называют удобрениями.

Рабочая гипотеза: Получив данные о классификации минеральных удобрений, необходимо исследовать их состав и свойства, научиться распознавать образцы важнейших удобрений; выяснить, какое влияние оказывают минеральные удобрения на питание растений.

Проверка гипотезы экспериментом Цель: отработка учебных приемов исследовательской деятельности «Деяние есть живое единство теории с практикой» Аристотель

Химический эксперимент (фронтальная работа) Исследование минеральных удобрений Вещество Х: белые гранулы, легко сублимируются при нагревании, растворяются в воде, а при добавлении к раствору нескольких капель раствора хлорида бария образуется белый осадок; при растворении гранул в щелочи и нагревании образуется газ с резким запахом, который изменяет цвет влажной лакмусовой бумажки из красного в синий. Вещество У: серые гранулы, нерастворимые в воде; при добавлении нескольких капель раствора нитрата серебра образуется желтый осадок; окрашивает пламя в кирпично-красный цвет. При добавлении карбоната калия выпадает белый осадок

Определение удобрения X Вывод Вещество X – сульфат аммония Реактивы Вещества Раствори- мость в воде BaCl2 NaOH, t Х P BaSO4 Белый осадок NH3 Резкий Запах. Индик.бумага синеет

Определение удобрения Y Вывод Вещество Y – суперфосфат Реактивы Вещества Раствори- мость в воде AgNO3 К2СО3 У Н Ag3РО4 желтый осадок СаСО3 Белый осадок

Задание для группы №1 «Незадачливый фермер» Поздней осенью, распахав землю, фермер решил, что называется убить двух зайцев сразу: известковать участки с кислой почвой и провести подкормку ее суперфосфатом (все-таки поверил, что без химии не обойтись). Однако весной оказалось, что желаемый эффект не был достигнут. Почему?

Помощь фермеру Са(Н2РО4)2 + 2Са(ОН)2 = =Са3(РО4)2 + 4Н2О осадок К какому типу относится реакция? К каким классам соединений относятся данные вещества? Назовите эти соединения.

Задание для группы №2 «Опытный сосед» Опытный сосед, пожалев молодого фермера, предложил ему исправить ошибку, внеся в почву хорошо растворимое удобрение, содержащее фосфор. Он позабыл его название, но принес аккуратную запись результатов анализа (%): Азота – 12,2, Водорода – 5,5, Фосфора – 27,0, Кислорода – 55,6. Что же это за вещество?

Помощь фермеру Дано: Решение: W(N) = 12,2% Отношение элементов в веществе W(Н) = 5,5% N : Н : Р : О = W(Р) = 27,0% 12,2/14 : 5,5/1 : 27,0/31 : 55,6/16 = W(О) = 55,6% 0,87 : 5,5 : 0,87 : 3,47 = ______________ 1 : 6 : 1 : 4 Формула ? NН6РО4 или NН4 Н2РО4 Ответ: NН4 Н2РО4 – дигидроортофосфат аммония

Задание для группы №3 «Молодой огородник» Молодому огороднику необходимо внести в почву минеральное удобрение, но на упаковке не сохранилось ни название, ни его формула. К счастью сохранилась следующая запись: азота 12.2%, водорода – 5.5%, фосфора 27.0%, кислорода 55.6%. Сможет ли огородник по указанным данным определить это вещество?

Задание для группы №4 «Химическое производство» Сегодня химическая промышленность создает новые рецептуры удобрений с улучшенными качествами. Это – суперфосфат, аммофос, сильвинит и другие. Чтобы получить растворимый в почве суперфосфат, восстанавливают углем природный фосфат: Продукт реакции – двойной суперфосфат (Ca(H2PO4)2) так называется из-за процесса, который идет в две стадии, а также он содержит около 50% Р2О5, а простой содержит 20%. Составьте цепочку превращений от природного фосфата до двойного суперфосфата. Запишите уравнения реакций.

Ответ : Ca3(PO4)2 P P2O5 H3PO4 Ca(H2PO4)2 1.Ca3(PO4)2 + 5C + 3 SiO2 = 2P + 5CO + 3 CaSiO3 2.4P + 5O2 = 2P2O5 3.P2O5 + 3H2O = 2H3PO4 4.Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2

Недостаток питательных элементов: Пожелтевшие нижние листья —признак недостатка азота. Признаки недостатка фосфора на листьях. Пожелтение и отмирание кончиков листьев — признаки недостатка калия.
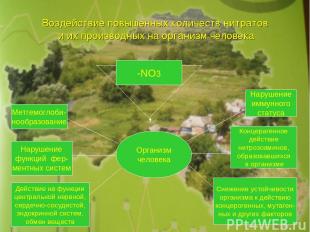
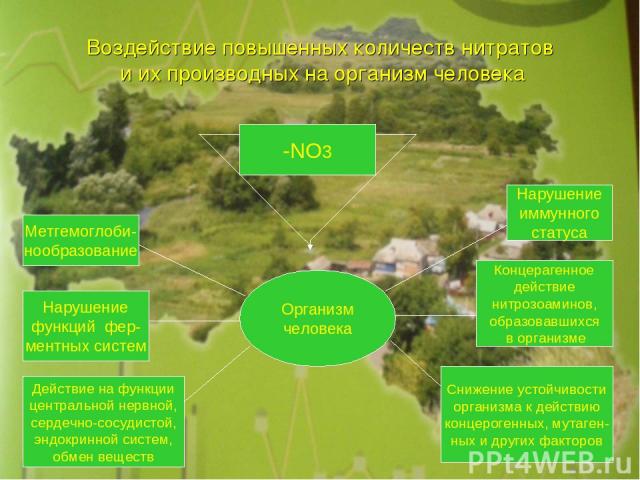
Воздействие повышенных количеств нитратов и их производных на организм человека -NO3 Организм человека Метгемоглоби- нообразование Нарушение функций фер- ментных систем Действие на функции центральной нервной, сердечно-сосудистой, эндокринной систем, обмен веществ Нарушение иммунного статуса Концерагенное действие нитрозоаминов, образовавшихся в организме Снижение устойчивости организма к действию концерогенных, мутаген- ных и других факторов
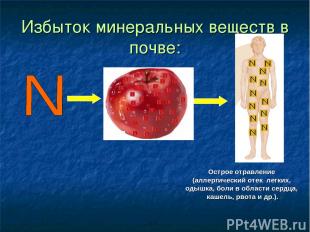
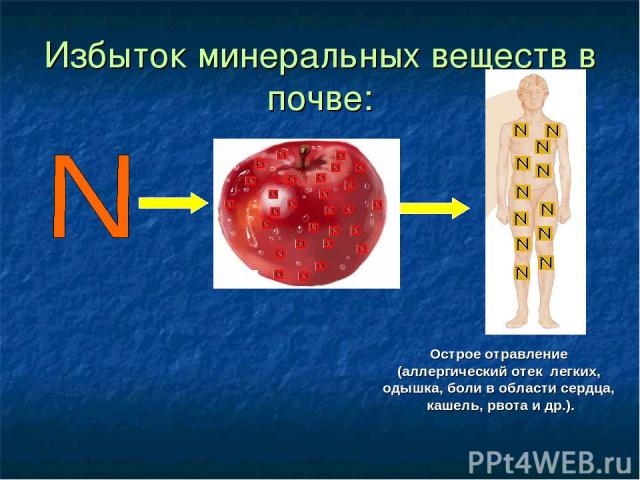
Избыток минеральных веществ в почве: Острое отравление (аллергический отек легких, одышка, боли в области сердца, кашель, рвота и др.).

Удобрения

Рефлексия Китайская мудрость гласит «Даже если вы достигли вершины горы, продолжайте карабкаться дальше»

«Первое яблоко тому, кто рассказывал. Второе – тому, кто слушал. А третье-кому? Тому – кто понял!» Из армянской сказки

Спасибо за сотрудничество! Урок окончен! До свидания! Всем добра и успехов!