Презентация на тему: Ацетилен и его гомологи

Тема урока: «Ацетилен и его гомологи. Состав, строение, изомерия, свойства, применение» Уварова Е.В., учитель химии МОУ СОШ № 5 г. Калининград 900igr.net

Цели урока на основе предложенных ресурсов: презентация, созданная в Power Point, Интернет-ресурсы, «Виртуальная лаборатория. Химия 8-11 класс» изучить тему урока по предложенному плану

Изучение темы урока по плану: Состав: общая формула, простейшие представители данного класса, номенклатура соединений. Особенности строения: наличие тройной (кратной) связи, тип гибридизации. Изомерия и ее виды. Свойства веществ: физические и химические. Применение.

Ресурсы Интернета http://cnit.ssau.ru/organics/index.htm

Цели урока закрепить полученные знания: Выполнить задания с 1 по 6, находящиеся в слайдах презентации № 31-35

АЛКИНЫ Алкины (ацетиленовые углеводороды) – непредельные алифатические углеводороды, молекулы которых содержат одну тройную связь. Общая формула алкинов СnH2n-2. *

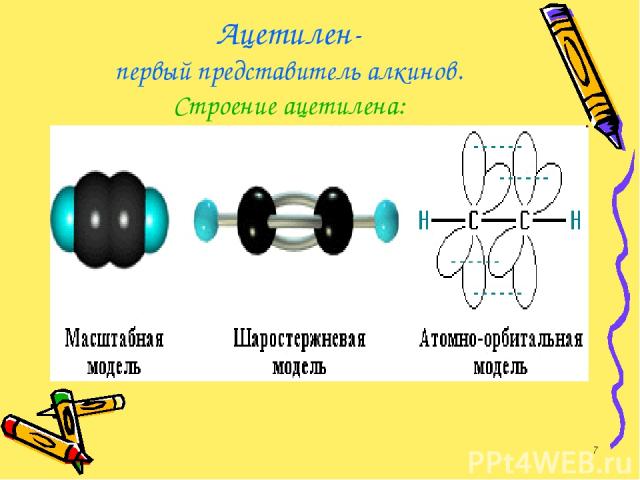
Ацетилен- первый представитель алкинов. Строение ацетилена: *

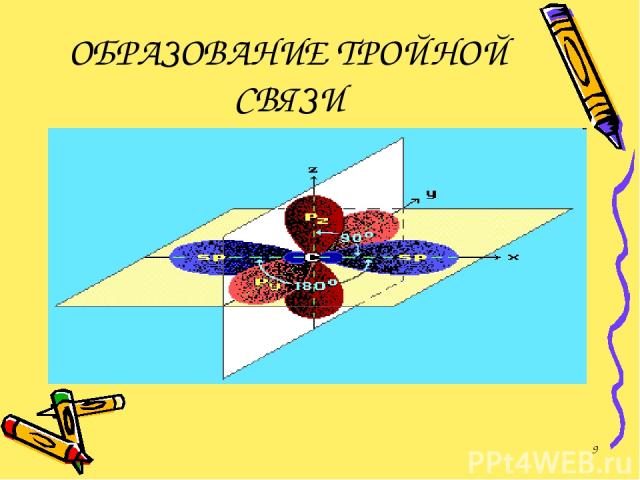
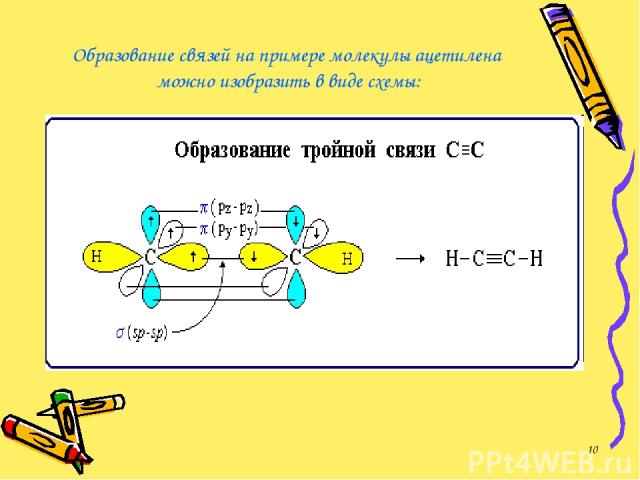
В молекуле ацетилена атомы углерода связаны тройной связью. Тройная связь - это комбинация одной s- и двух p-связей. Атомы углерода, входящие в состав молекулы ацетилена, находятся в состоянии sp-гибридизации. Задание 1: слайд № 30 *
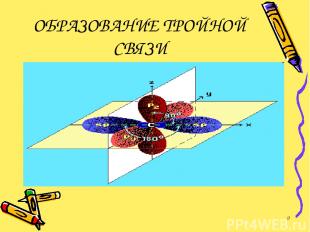
ОБРАЗОВАНИЕ ТРОЙНОЙ СВЯЗИ *
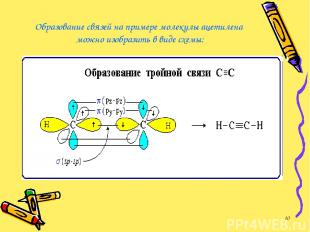
Образование связей на примере молекулы ацетилена можно изобразить в виде схемы: *

АЛКИНЫ Общая формула алкинов СnH2n-2. Простейшие представители. Задание 2: С помощью конструктора формул в «Виртуальной лаборатории. Химия 8-11 класс» составить приведенные ниже формулы углеводородов. *

Номенклатура алкинов По систематической номенклатуре названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ин: 2 атома С ® этан ® этин; 3 атома С ® пропан ® пропин и т.д. Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь Нумерацию углеродных атомов начинают с ближнего к тройной связи конца цепи. Цифра, обозначающая положение тройной связи, ставится обычно после суффикса –ин. ЗАДАНИЕ 3: Слад № 29 *

Изомерия алкинов Структурная изомерия Изомерия углеродного скелета (начиная с С5Н8): *

Изомерия положения тройной связи (начиная с С4Н6): *

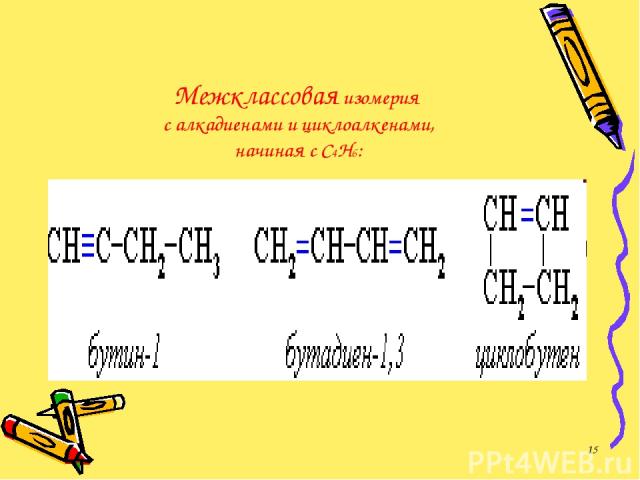
Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6: *

Пространственная изомерия относительно тройной связи в алкинах не проявляется, т.к. заместители могут располагаться только одним способом - вдоль линии связи. Задание 4: Слайд № 31 *
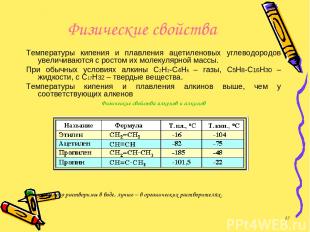
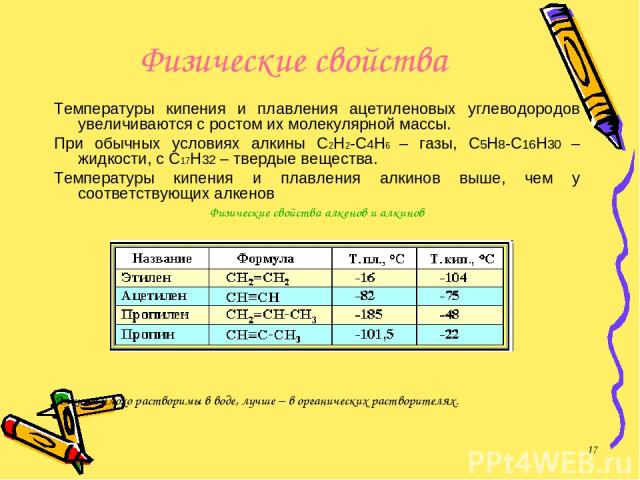
Физические свойства Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы. При обычных условиях алкины С2Н2-С4Н6 – газы, С5Н8-С16Н30 – жидкости, с С17Н32 – твердые вещества. Температуры кипения и плавления алкинов выше, чем у соответствующих алкенов Физические свойства алкенов и алкинов Алкины плохо растворимы в воде, лучше – в органических растворителях. *

Химические свойства алкинов Химические свойства алкинов сходны с алкенами, что обусловлено их ненасыщенностью. Характеристики связей в алкинах: Некоторые отличия в свойствах алкинов и алканов определяются следующими факторами. p-Электроны более короткой тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью (подвижностью). Поэтому реакции присоединения к алкинам протекают медленнее, чем к алкенам. *

Гидрирование В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов (разрывается первая p-связь), а затем алканов (разрывается вторая p-связь): *

Галогенирование присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая p-связь разрывается труднее, чем вторая): *
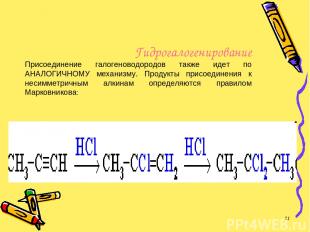
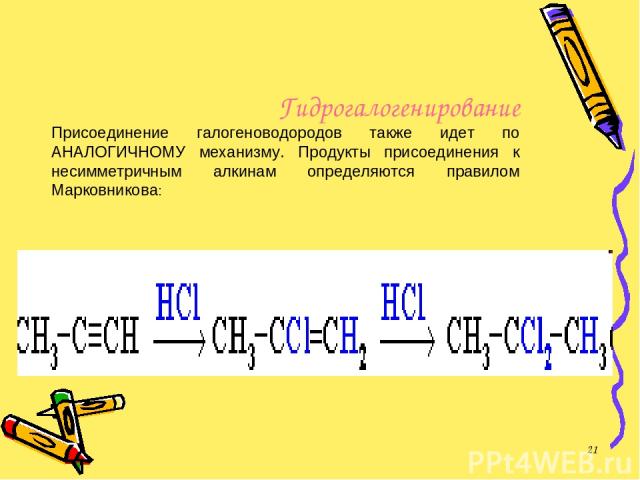
Гидрогалогенирование Присоединение галогеноводородов также идет по АНАЛОГИЧНОМУ механизму. Продукты присоединения к несимметричным алкинам определяются правилом Марковникова: *

Гидратация (реакция Кучерова) Присоединение воды происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта, который изомеризуется в уксусный альдегид (в случае ацетилена): *
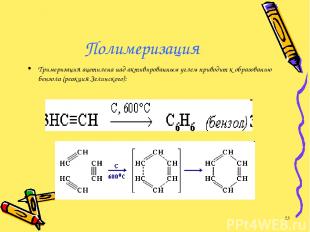
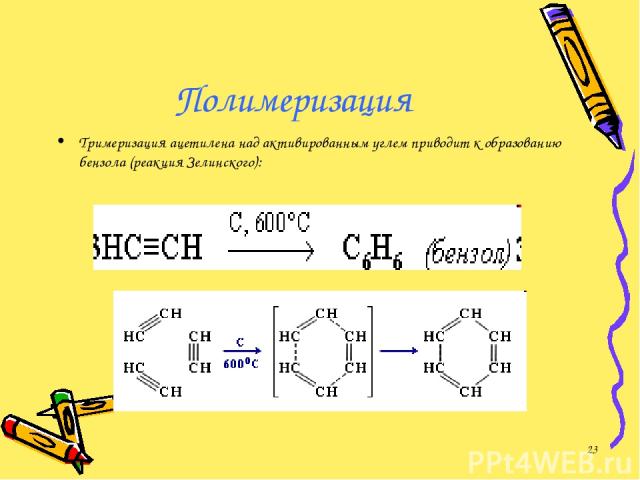
Полимеризация Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского): *

Окисление алкинов Ацетилен и его гомологи окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот: Алкины обесцвечивают раствор KMnO4, что используется для их качественного определения. *

РЕАКЦИЯ ГОРЕНИЯ АЦЕТИЛЕНА При сгорании (полном окислении) ацетилена выделяется большое количества тепла: Температура ацетиленово-кислородного пламени достигает 2800- 3000°С. На этом основано применение ацетилена для сварки и резки металла. Ацетилен образует с воздухом и кислородом взрывоопасные смеси. В сжатом, и особенно в сжиженном, состоянии он способен взрываться от удара. Поэтому ацетилен хранится в стальных баллонах в виде растворов в ацетоне, которым пропитывают асбест. *

Получение алкинов Термический крекинг метана: Гидролиз карбида кальция: Карбид кальция образуется при нагревании смеси оксида кальция СаО (жженой извести) и кокса до 2500°С: Вследствие большой энергоемкости этот метод экономически менее выгоден. Задание 5: Слайд № 32 *

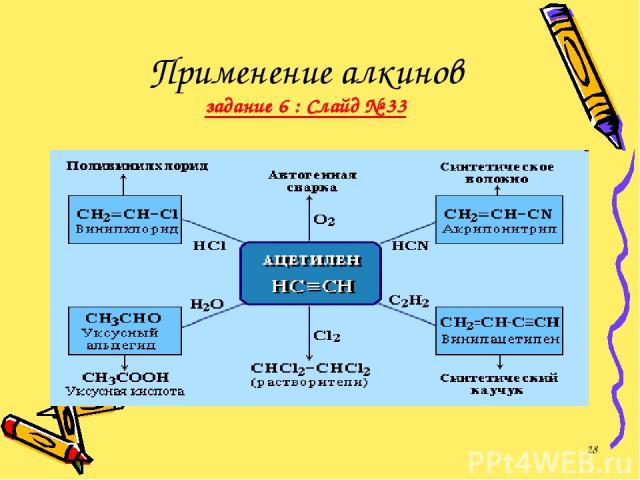
ПРИМЕНЕНИЕ АЛКИНОВ Наибольшее значение среди алкинов имеет ацетилен. Разработано несколько способов его получения, применяющихся в промышленном органическом синтезе. *
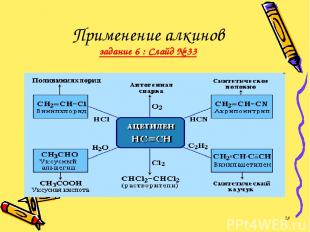
Применение алкинов задание 6 : Слайд № 33 *
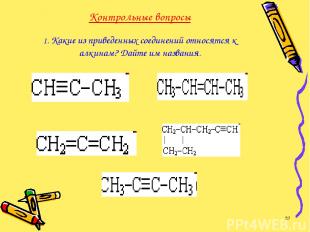
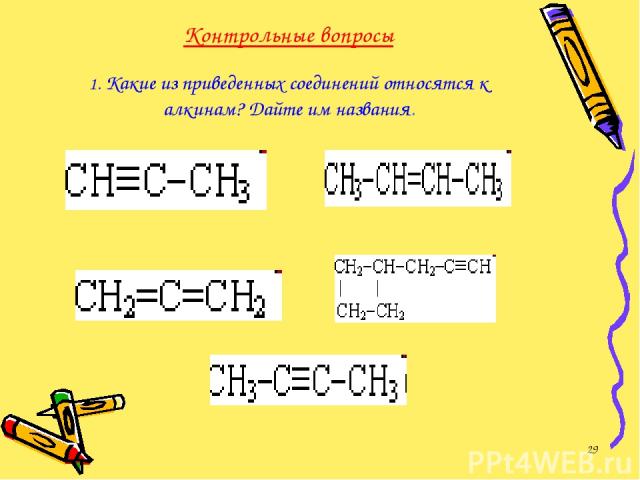
Контрольные вопросы 1. Какие из приведенных соединений относятся к алкинам? Дайте им названия. *

2. Какова гибридизация атомов углерода в следующей молекуле органического вещества? *
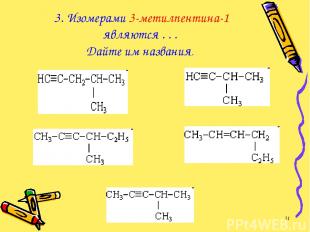
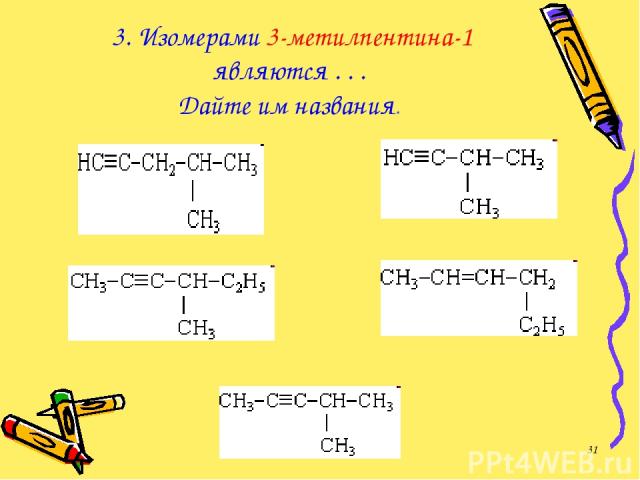
3. Изомерами 3-метилпентина-1 являются . . . Дайте им названия. *

4.Завершите уравнения химических реакций, назовите продукты реакций. *Составьте уравнения хим. реакций для пропина, бутина-1 ,бутина-2. *

5. Где применяется ацетилен и его гомологи? *

Домашнее задание: УЧЕБНИК О.С. ГАБРИЕЛЯН « ХИМИЯ-10» СТР.99-108, СТР.109 УПР. 2, 4(А,Б,В) *

БЛАГОДАРЮ ЗА УРОК!!!!!!! *