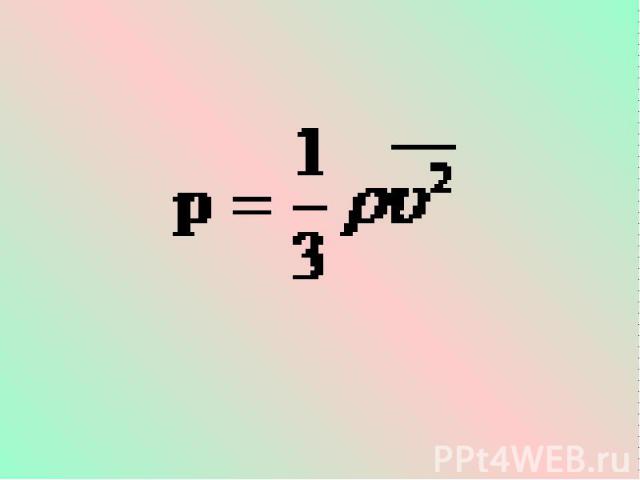Презентация на тему: Основное уравнение МКТ

Урок №3 Основное уравнение МКТ

Цель урока:Установить взаимосвязь между макроскопическими и микроскопическими параметрамиНаучиться решать вычислительные задачи с использованием основного уравнения МКТ

Макроскопические – параметры, которые можно измерить с помощью приборов.Микроскопические – параметры, которые измеряются косвенным путем.

m – масса газа V – объем газаt – температура газаp – давление газаn - концентрация


Модель идеального газа1. Межмолекулярные силы притяжения отсутствуют (можно пренебречь потенциальной энергией)2. Взаимодействия молекул газа происходят только при их соударениях и являются упругими 3. Молекулы газа не имеют объема - рассматриваются как материальные точки
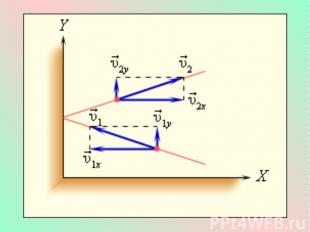

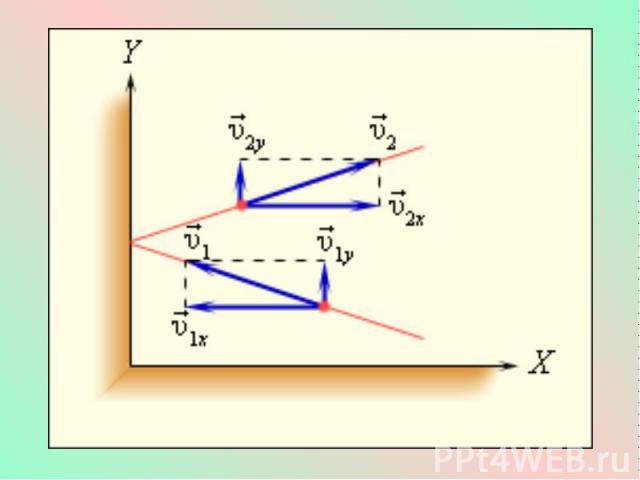
Это уравнение, выведенное впервые немецким физиком Р. Клаузиусом, называется основным уравнением молекулярно-кинетической теории идеального газа. Оно устанавливает связь между микроскопическими параметрами и макроскопическими (измеряемыми) величинами.

Учитывая, что - средняя кинетическая энергия молекулы газа, получим:

Давление идеального газа прямо пропорционально средней кинетической энергии поступательного движения молекул, содержащихся в единице объема газа.
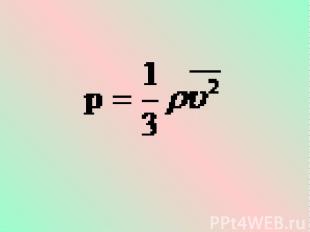

Задача №1.Каково давление азота, если средняяквадратичная скорость его молекул 500 м/с, а его плотность 1,36 кг/м3 ?


Задача №2. Имеются два одинаковых сосуда. В одном из них находится кислород, а в другом азот. Число молекул каждого газа и средние квадраты их скоростей одинаковы. Давление кислорода равно 32 кПа. Чему равно давление азота?