Презентация на тему: Вода источник жизни

ОКСИДЫ КЛАССИФИКАЦИЯ. ХИМИЧЕСКИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА.
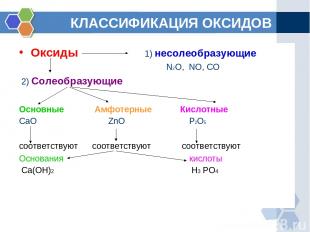
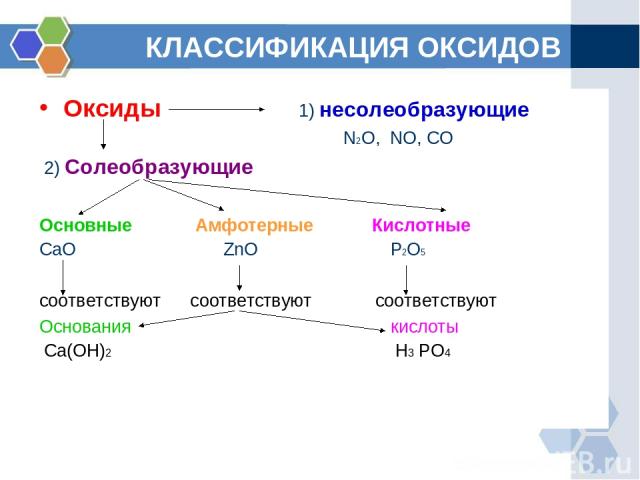
КЛАССИФИКАЦИЯ ОКСИДОВ Оксиды 1) несолеобразующие N2O, NO, CO 2) Солеобразующие Основные Амфотерные Кислотные CaO ZnO P2O5 соответствуют соответствуют соответствуют Основания кислоты Ca(OH)2 H3 PO4

ОПРЕДЕЛЕНИЕ ГРУПП ОКСИДОВ Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами. Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами. Амфотерными оксидами, называют оксиды которые проявляют свойства как кислот, так и оснований.

НАПМИСАТЬ ХИМИЧЕСКИЕ ФОРМУЛЫ ОКСИДОВ 1)Оксид серы(IV) 2)Оксид азота(V) 3)Оксид калия (I) 4)Оксид железа(II) 5)Оксид фосфора(V) 6) оксид натрия (I)
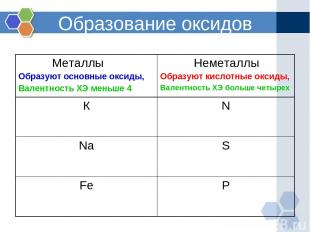
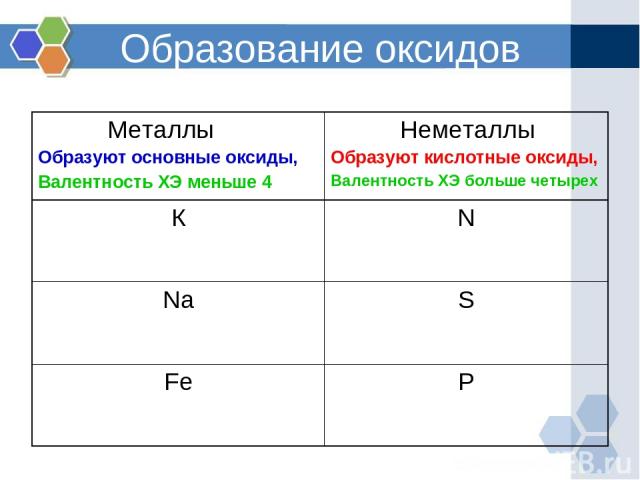
Образование оксидов Металлы Образуют основные оксиды, Валентность ХЭ меньше 4 Неметаллы Образуют кислотные оксиды, Валентность ХЭ больше четырех К N Na S Fe P

ФОРМУЛЫ ОКСИДОВ 1)Оксид серы(IV) 2)Оксид азота(V) 3)Оксид калия (I)- основной оксид 4)Оксид железа(II) – основной оксид 5)Оксид фосфора(V) 6) оксид натрия (I)- основной оксид
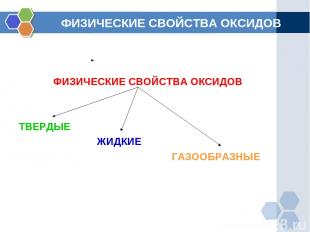
ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ ТВЕРДЫЕ ЖИДКИЕ ГАЗООБРАЗНЫЕ

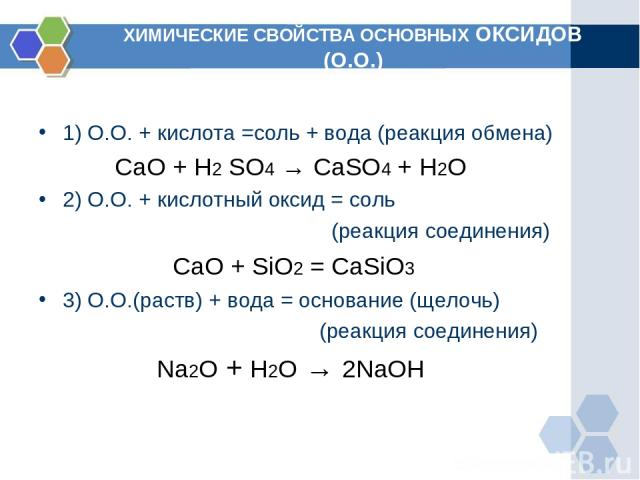
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ (О.О.) 1) О.О. + кислота =соль + вода (реакция обмена) CaO + H2 SO4 → CaSO4 + H2O 2) О.О. + кислотный оксид = соль (реакция соединения) СaO + SiO2 = CaSiO3 3) О.О.(раств) + вода = основание (щелочь) (реакция соединения) Na2O + H2O → 2NaOH

Химические свойства кислотных оксидов (К.О.) 1) К.О. + основание = соль + вода (реакция обмена) SO3 + 2NaOH → Na2SO4 + H2O 2) К.О. +О.О. = СОЛЬ (реакция соединения) SO3 + Na2O → Na2SO4. 3) К.О. + вода = кислота (кроме SiO2 ) (реакция соединения) P2O5 + 3H2O → 2H3PO4

Амфотерные оксиды 1) с кислотами как основные ZnO + 2HCl = ZnCl2 + H2O 2) с основаниями как кислотные ZnO + 2NaOH = Na2ZnO + H2O (цинкат натрия)

ДОМАШНЯЯ РАБОТА П. 30 1) способы получения стр. 91 (выписать в тетрадь и выучить) 2) стр. 92 №1,3