Презентация на тему: Азотная кислота HNO3 – "взрывоопасная царская особа".

Азотная кислота – HNO3 – «взрывоопасная царская особа» МБОУ «Рождественская средняя общеобразовательная школа» Собинского района Прохорова Ирина Александровна учитель биологии и химии

И это всё о ней… Это вещество было описано в VIII веке арабским алхимиком Джабиром ибн Хайяаном (Гебером) в труде «Ямщик мудрости», а с ХV века это вещество добывалось для производственных целей. Она - прародитель большинства взрывчатых веществ (например, тротила, или тола). В 1866 году русский учёный В.Ф. Петрушевский впервые получил динамит. Это вещество является компонентом ракетного топлива. Её использовали для двигателя первого в мире советского реактивного самолёта БИ – 1. Она в смеси с соляной кислотой (в соотношении 1v : 3v) растворяет платину и царский металл золото, а сама смесь названа «царской водкой». Её используют в производстве минеральных удобрений, медицинских препаратов, красителей, пластмасс, фотоматериалов.

Знаете ли Вы, почему HNO3 назвали… к и с л о т о й ? взрывоопасной ? особой ? царской ?

И у веществ есть своя биография… 1. П О Л У Ч Е Н И Е VIII век, арабский алхимик Джабир ибн-Хайяан (Гебер) «Ямщик мудрости» - описание азотной кислоты. с ХV века -получение кислоты для производственных целей. с 1916-1917 г.г., Россия, И.И. Андреев - азотнокислотное производство: + H2 (t; Fe) +O2 (t; Pt) +O2 (p) +H2O (p) N2 → NH3 → NO → NO2 → HNO3 - Н2O - NO
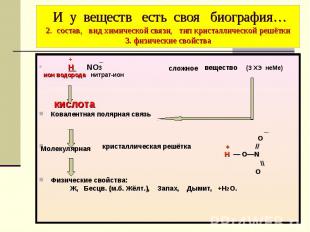
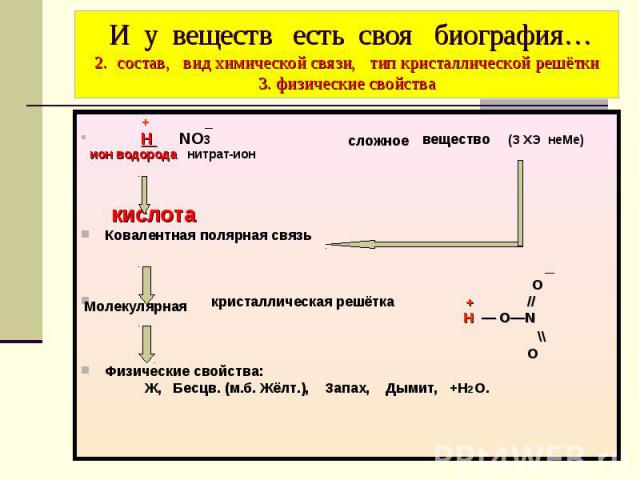
И у веществ есть своя биография… 2. состав, вид химической связи, тип кристаллической решётки 3. физические свойства + _ Н NO3 вещество (З ХЭ неМе) ион водорода нитрат-ион кислота Ковалентная полярная связь _ O кристаллическая решётка + // Н — O―N \\ O Физические свойства: Ж, Бесцв. (м.б. Жёлт.), Запах, Дымит, +Н2О.
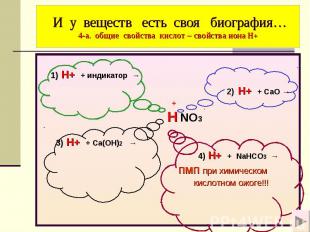
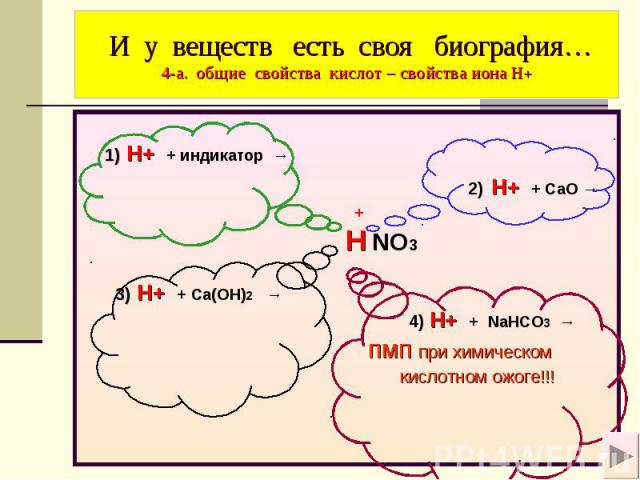
И у веществ есть своя биография… 4-а. общие свойства кислот – свойства иона Н+ 1) H+ + индикатор → 2) H+ + СaO → + H NO3 3) H+ + Ca(OH)2 → 4) H+ + NaHCO3 → пмп при химическом кислотном ожоге!!!

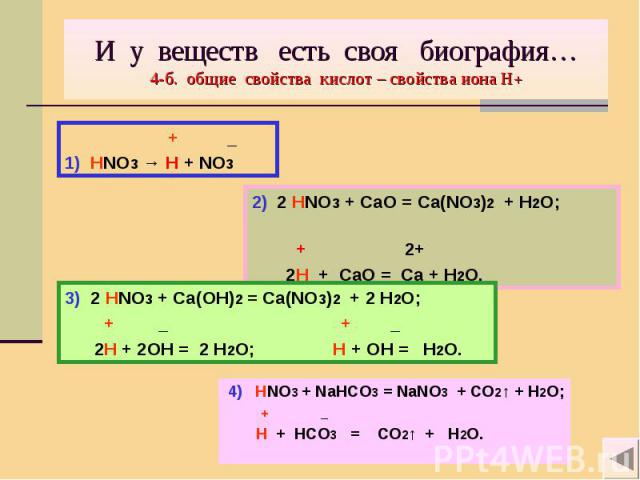
И у веществ есть своя биография… 4-б. общие свойства кислот – свойства иона Н+
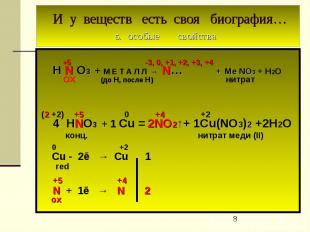
И у веществ есть своя биография… 5. особые свойства +5 -3, 0, +1, +2, +3, +4 H N O3 + М Е Т А Л Л → N… + Ме NO3 + Н2О ОХ (до Н, после Н) нитрат (2 +2) +5 0 +4 +2 4 HNO3 + 1 Cu = 2NO2↑+ 1Cu(NO3)2 +2Н2О конц. нитрат меди (II) 0 +2 Cu - 2ē → Cu 1 red +5 +4 N + 1ē → N 2 ox

И у веществ есть своя биография… 5-а. особое «царское» свойство 1 HNO3 + 3 HCl «Царская водка» + Аu «Царь» металлов

И у веществ есть своя биография… 5-б. особое «взрывоопасное» свойство 4 HNO3 t 4 NO2 ↑ («лисий хвост») + О2 ↑ + 2 Н2О Тип реакции? Чем опасна эта реакция?

Эта страница для Ваших открытий… А пока … Д/З: § 27 (с.156-157), закончить и выучить записи в кластере. «База»: с.158 № 2, 4 (для конц.), 6 (расч. задача без «68%», с «276 г»). «База+»: с.158 № 4 (для Аg), 5 (для N2), 6 (расч. задача).

И у веществ есть своя биография… 6. п р и м е н е н и е Минеральные удобрения – производные азотной кислоты. HNO3 + NH3 → NH4NO3 (аммиачная селитра) НИТРАТ … НИТРАТЫ ВРЕДНЫ ?