Презентация на тему: Урок Углерод

Урок химии 9 класс Общая характеристика элементов подгруппы углерода. Углерод, нахождение в природе, аллотропные видоизменения, химические свойства углерода. 900igr.net

Девиз урока «Мы столько можем, сколько знаем. Знания – сила». Ф.Бэкон

Цель урока: дать общую характеристику элементам подгруппы углерода понятие аллотропии на примере алмаза и графита показать сущность биосферного значения углерода закрепить и углубить знания учащихся об окислительно-восстановительной двойственности на примере атома углерода.

Вопросы к теме урока Характеристика элементов подгруппы углерода. Биологическое значение углерода. Нахождение углерода в природе. Аллотропные видоизменения углерода – алмаз, графит, фуллерен, карбин. Химические свойства углерода. Основные области применения углерода.

Характеристика подгруппы углерода Углерод, кремний, германий, олово и свинец составляют главную подгруппу 4 группы. Внешние энергетические уровни р- элементов 4 группы содержат по 4 электрона, из которых два спаренных s-электрона и два не спаренных р- электрона Электронные конфигурации данных атомов…….(составляют на доске учащиеся) Возможные степени окисления ……(ответы учащихся) Усиление металлических свойств в подгруппе (вывод делают учащиеся)

Биологическое значение углерода Все без исключения живые организмы построены из соединений углерода.
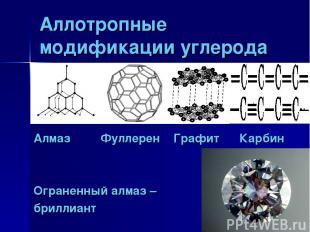
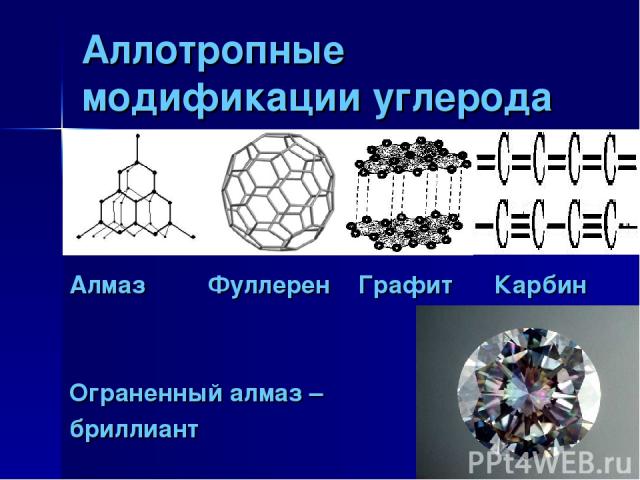
Аллотропные модификации углерода Алмаз Фуллерен Графит Карбин Ограненный алмаз – бриллиант

Основные области применения углерода.
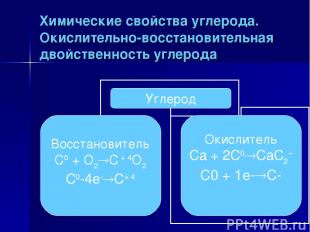
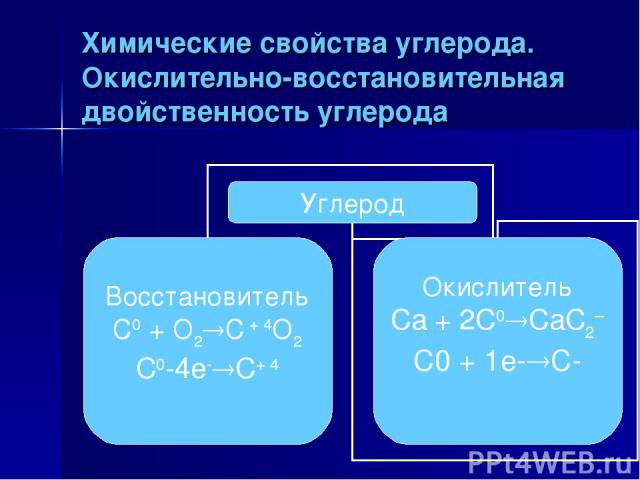
Химические свойства углерода. Окислительно-восстановительная двойственность углерода
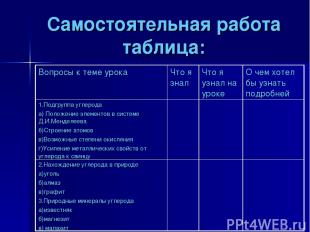
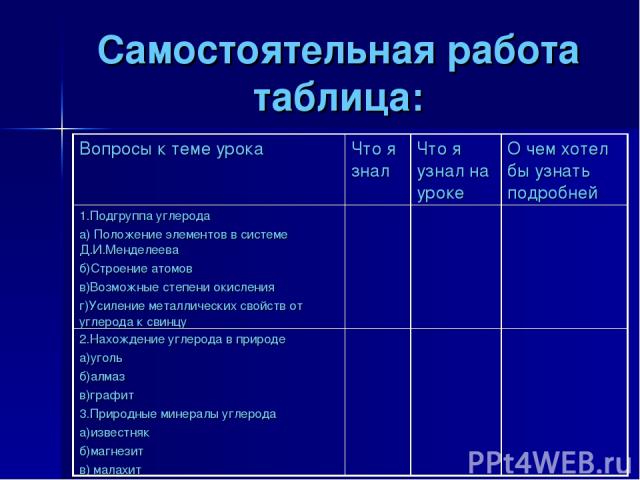
Самостоятельная работа таблица: Вопросы к теме урока Что я знал Что я узнал на уроке О чем хотел бы узнать подробней 1.Подгруппа углерода а) Положение элементов в системе Д.И.Менделеева б)Строение атомов в)Возможные степени окисления г)Усиление металлических свойств от углерода к свинцу 2.Нахождение углерода в природе а)уголь б)алмаз в)графит 3.Природные минералы углерода а)известняк б)магнезит в) малахит

Самостоятельная работа Вариант А: Составить уравнение реакции, в которой углерод – окислитель, показать переход электронов. Вычислить объем оксида углерода (IV), если сгорело 5 кг угля, содержащего 20% примесей.

Самостоятельная работа Вариант В Составить схемы электронного баланса следующих реакций: Ca + 2C = CaC2 4A1 + 3C = A14C3 C + 2FeO = 2Fe + CO2

Самостоятельная работа Вариант C: Закончить следующие уравнения: C + O2 C + H2 Al + C

Биологическое значение углерода в том, что все ,без исключения живые организмы построены из соединений углерода. Особенностью атомов углерода является их способность соединяться между собой, образуя длинные цепи, содержащие миллионы и миллиарды атомов углерода, соединенных с атомами других элементов. Возможные степенями окисления углерода +4,+2,-4. Углерод может быть как окислителем ,так и восстановителем, чаще окислительные свойства он проявляет с водородом и металлами, с кислородом, оксидами, углерод-восстановитель. Аллотропные модификации углерода – алмаз ,графит, карбин, фуллерен. Выводы к уроку Биологическое значение углерода в том, что…(?) Особенностью атомов углерода является их способность образовывать…(?) Возможные степени окисления углерода…(?) Углерод в химических реакциях проявляет окислительно-восстановительную двойственность, например… Аллотропные модификации углерода, это…(?)

Домашнее задание § 37, 38. Упражнение №1 стр – 154, №4 стр – 154