Презентация на тему: ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ


Актуализация опорных знаний Актуализация опорных знаний Изучение нового материала Первичное закрепление знаний и умений Подведение итогов урока. Рефлексия Домашнее задание Глоссарий Список литературы


по числу и составу исходных веществ и продуктов реакции реакция соединения реакция разложения реакция замещения реакция обмена по тепловому эффекту экзотермическая реакция эндотермическая реакция

Реакция соединения – реакция, в ходе, которой из нескольких простых и сложных веществ образуется одно более сложное вещество. Реакция соединения – реакция, в ходе, которой из нескольких простых и сложных веществ образуется одно более сложное вещество. Взаимодействие оксида кальция с водой CaO + H2O = Ca(OH)2 Взаимодействие оксида серы (IV) с водой SO2 + H2O = H2SO3 Горение оксида серы (IV) 2SO2 + O2 = 2SO3

Реакция разложения – реакция, в которой из одного исходного вещества образуется несколько новых веществ. Реакция разложения – реакция, в которой из одного исходного вещества образуется несколько новых веществ. Электролиз воды 2H2O = 2H2 + O2 Разложение нитрата калия 2KNO3 = 2KNO2 + O2 Разложение перманганата калия 2KMnO4 = K2MnO4 + MnO2 + O2

Реакция замещения – реакция между простым и сложным веществами, в результате которой атомы простого вещества замещают атомы одного из элементов сложного вещества. Реакция замещения – реакция между простым и сложным веществами, в результате которой атомы простого вещества замещают атомы одного из элементов сложного вещества. Взаимодействие цинка с соляной кислотой Zn + 2HCl = ZnCl2 + H2 Взаимодействие натрия с водой 2Na + 2H2O = 2NaOH + H2 Взаимодействие железа с раствором сульфата меди (II) Fe + CuSO4 = FeSO4 + Cu↓

Реакция обмена – реакция, в результате которой два вещества обмениваются своими составными частями, образуя два новых вещества. Реакция обмена – реакция, в результате которой два вещества обмениваются своими составными частями, образуя два новых вещества. Взаимодействие растворов сульфата меди (II) и гидроксида калия CuSO4 + 2KOH = Cu(OH)2 + K2SO4 Взаимодействие раствора гидроксида натрия с азотной кислотой NaOH + HNO3 = NaNO3 + H2O Взаимодействие хлорида аммония с гидроксидом кальция 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O

Экзотермические реакции – реакции, протекающие с выделением энергии (тепла). Экзотермические реакции – реакции, протекающие с выделением энергии (тепла). Горение фосфора в кислороде 4P + 5O2 = 2P2O5 + Q кДж Горение этилового спирта C2H5OH + 3O2 = 2CO2 + 3H2O + Q кДж

Эндотермические реакции – реакции, протекающие с поглощением энергии (тепла). Эндотермические реакции – реакции, протекающие с поглощением энергии (тепла). Горение азота в атмосфере кислорода N2 + O2 = 2NO – Q кДж Разложение оксида ртути 2HgO = 2Hg↓ + O2↑ – Q кДж Горение аммиака в кислороде 4NH3 + 5O2 = 4NO + 6H2O – Q кДж

Определите тип химической реакции. Определите тип химической реакции. Распределите предложенные вам уравнения, расставьте коэффициенты в уравнениях реакций. H2 + O2 = H2O NaOH + H3PO4 = Na3PO4 + H2O Fe(OH)3 = Fe2O3 + H2O P2O5 + H2O = H3PO4 Mg(OH)2 + HNO3 = Mg(NO3)2 + H2O Ca + H2O = Ca(OH)2 + H2 CaCO3 = CaO + CO2 Fe + HCl = FeCl2 + H2




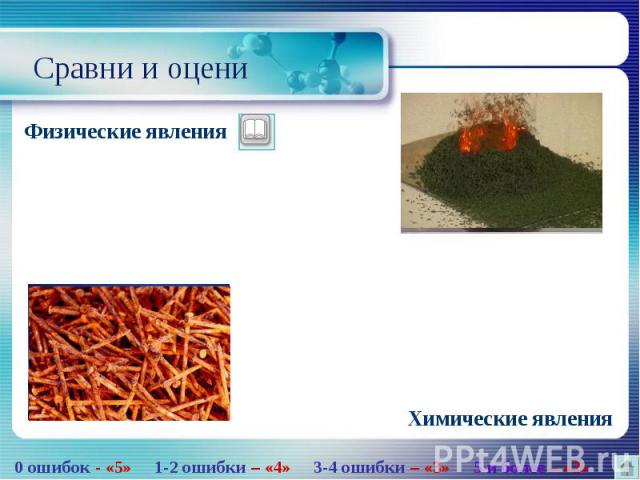
Химическая реакция – процесс превращения исходных веществ в продукты реакций. Химическая реакция – процесс превращения исходных веществ в продукты реакций. Физические явления – явления, приводящие к изменению формы или агрегатного состояния вещества, но не приводящие к образованию новых веществ. Химические явления – явления, при которых одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами. Электролиз – процесс, протекающий на электродах при пропускании электрического тока. Горение – физико-химический процесс, при котором превращение вещества сопровождается интенсивным выделением энергии (тепла). Коэффициенты – оказывают количество молекул данного вещества. Индексы – показывают количество атомов элемента в веществе. Уравнения реакций – условная запись химической реакции посредством химических формул и математических знаков.

Рудзитис Г. Е. Химия. Неорганическая химия. 8 класс : учеб, для общеобразоват. уч­реждений / Г. Е. Рудзитис, Ф. Г. Фельдман. - 13-е изд. - М. : Просвещение, 2011. - 176 с.: ил. Рудзитис Г. Е. Химия. Неорганическая химия. 8 класс : учеб, для общеобразоват. уч­реждений / Г. Е. Рудзитис, Ф. Г. Фельдман. - 13-е изд. - М. : Просвещение, 2011. - 176 с.: ил. Брейгер, Л. М. Нестандартные уроки. Химия. 8, 10, 11 классы / Л. М. Брейгер. - Вол­гоград : Учитель, 2004 http://www.nachalka.com/book/export/html/1325 http://www.youtube.com/watch?v=Le3Jxjx7ABs http://www.himikatus.ru/art/nvideo_neorg/razlojenem.php http://www.himikatus.ru/art/nvideo_neorg/gorenieamm.php http://yandex.ru/yandsearch?text=%D1% http://images.yandex.ru/yandsearch?stype=image&lr=51&noreask=1&source=psearch&text=%D1%84%