Презентация на тему: УГЛЕВОДОРОДЫ

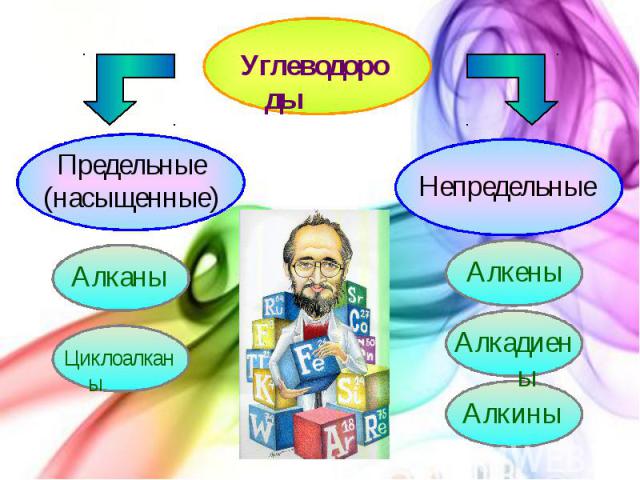
Углеводороды

Алканы (парафины) К алканам (парафинам) относятся соединения с открытой цепью, в которых атомы углерода соединены друг с другом простыми (одинарными) связями, а остальные свободные их валентности насыщены атомами водорода. В обычных условиях алканы мало реакционноспособны, откуда возникло их название "парафины" – от лат. parrum affinis – малоактивный.
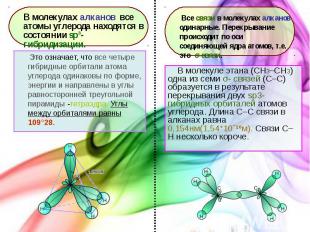
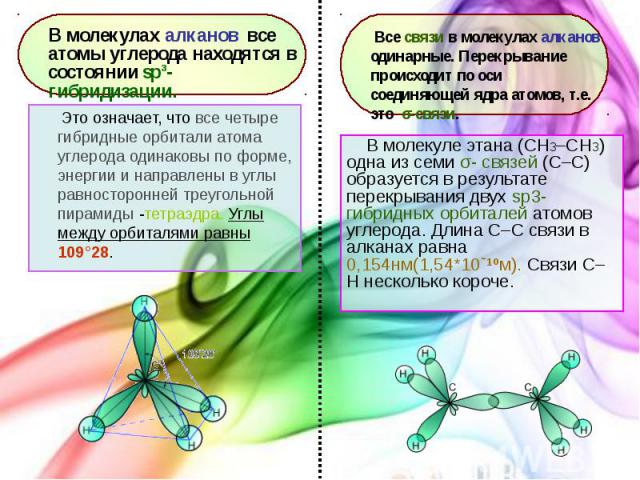
В молекуле этана (CH3–СH3) одна из семи σ- связей (С–С) образуется в результате перекрывания двух sp3- гибридных орбиталей атомов углерода. Длина С–С связи в алканах равна 0,154нм(1,54*10ˉ¹ºм). Связи С–Н несколько короче. В молекуле этана (CH3–СH3) одна из семи σ- связей (С–С) образуется в результате перекрывания двух sp3- гибридных орбиталей атомов углерода. Длина С–С связи в алканах равна 0,154нм(1,54*10ˉ¹ºм). Связи С–Н несколько короче.

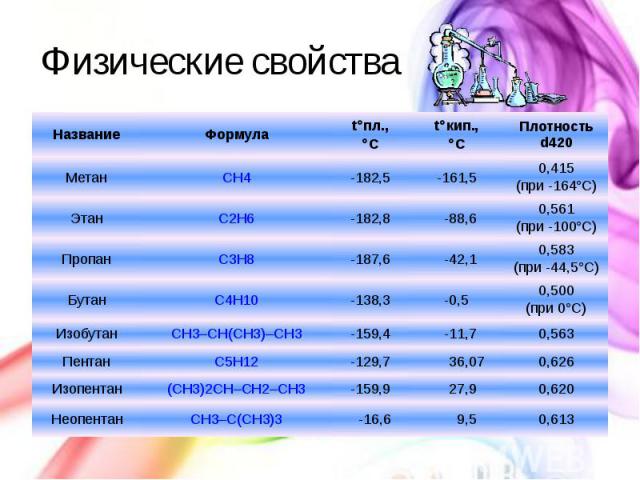
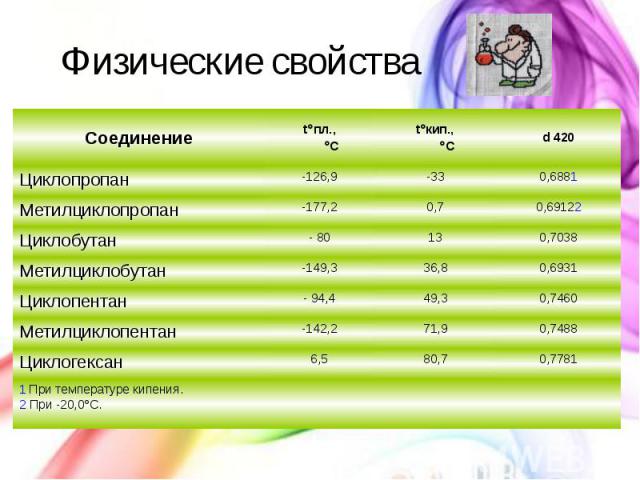
Физические свойства

Химические свойства

Применение

Циклоалканы (циклопарафины)
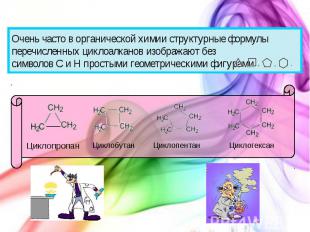
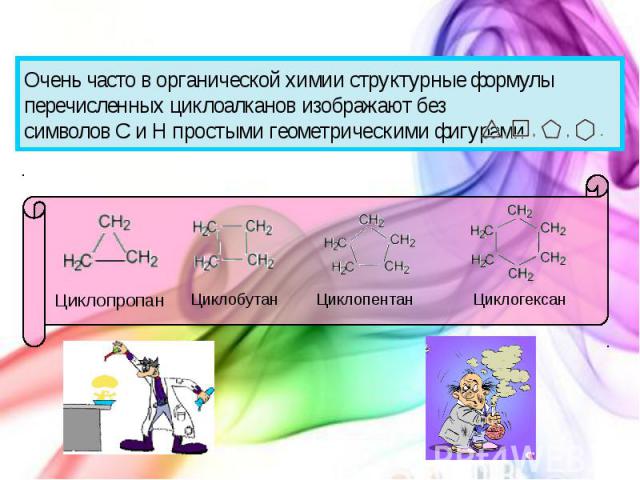
Очень часто в органической химии структурные формулы перечисленных циклоалканов изображают без символов C и H простыми геометрическими фигурами
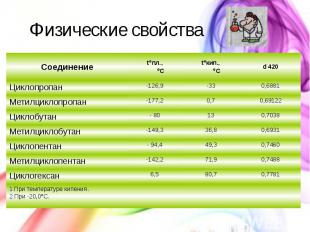
Физические свойства

Химические свойства Гидрирование: Галогенирование: Гидрогалогенирование: Дегидрирование:

Применение Наибольшее практическое значение имеют циклогексан, этилциклогексан. Циклогексан используется для получения циклогексанола, циклогексанона, адипиновой кислоты, капролактама, а также в качестве растворителя. Циклопропан используется в медицинской практике в качестве ингаляционного анестезирующего средства.

Алкены Алкенами или олефинами, или этиленовыми углеводородами называются углеводороды, содержащие в молекуле одну двойную связь.
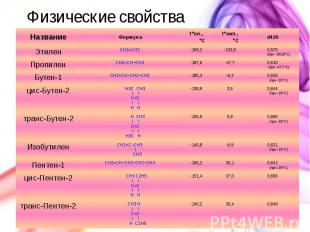
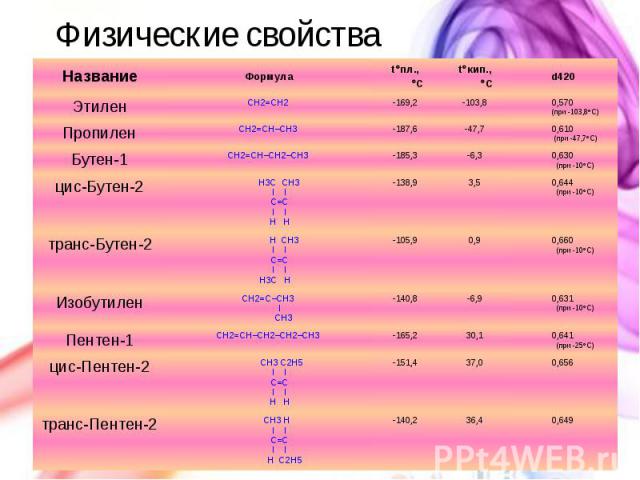
Физические свойства

Химические свойства Галогенирование: H2C=CH2 + Br2 → BrCH2­–CH2Br (1,2-дибромэтан) Гидрирование: CH3–CH=CH2 + H2 ––Ni→ CH3–CH2–CH3 (пропан) Гидрогалогенирование: H2C=CH2 + HBr → CH3–CH2Br(бромистый этил) Гидратация: СН2=СН2 + Н2О → СН3-СН2ОН (этанол) Полимеризация п СН2 = СН2 → ( … - СН2 - СН2- …) п (полиэтилен) Окисление 1. СН2=СН2 + 3 О2 → 2 СО2 + 2 Н2О 2. СН2 = СН2 + [ О ] + Н2О → СН2ОН – СН2ОН (этиленгликоль)

Применение Алкены широко используются в промышленности в качестве исходных веществ для получения растворителей (спирты, дихлорэтан, эфиры гликолей и пр.), полимеров (полиэтилен, поливинилхлорид, полиизобутилен и др.), а также многих других важнейших продуктов.

Диеновые углеводороды (Алкадиены) Диеновые углеводороды или алкадиены – это непредельные углеводороды, содержащие две двойные углерод - углеродные связи.

1) углеводороды с кумулированными двойными связями, т.е. примыкающими к одному атому углерода. Например, пропадиен или аллен CH2=C=CH2; 1) углеводороды с кумулированными двойными связями, т.е. примыкающими к одному атому углерода. Например, пропадиен или аллен CH2=C=CH2; 2) углеводороды с изолированными двойными связями, т.е разделенными двумя и более простыми связями. Например, пентадиен -1,4 CH2=CH–CH2–CH=CH2; 3) углеводороды с сопряженными двойными связями, т.е. разделенными одной простой связью. Например, бутадиен -1,3 или дивинил CH2=CH–CH=CH2, 2-метилбутадиен -1,3 или изопрен CH2=С–CH=CH2. I CH3

Физические свойства Бутадиен -1,3 – легко сжижающийся газ с неприятным запахом, t°пл.= -108,9°C, t°кип.= -4,5°C; растворяется в эфире, бензоле, не растворяется в воде. 2- Метилбутадиен -1,3 – летучая жидкость, t°пл.= -146°C, t°кип.= 34,1°C; растворяется в большинстве углеводородных растворителях, эфире, спирте, не растворяется в воде.

Алкины Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную связь.

Физические свойства

Химические свойства Реакции присоединения: Гидрирование: Галогенирование: Гидрогалогенирование: Тримеризация : 3HC≡CH → С6 Н6 (бензол)

Применение При горении ацетилена в кислороде температура пламени достигает 3150°C, поэтому ацетилен используют для резки и сварки металлов. Кроме того, ацетилен широко используется в органическом синтезе разнообразных веществ - например, уксусной кислоты, 1,1,2,2- тетрахлорэтана и др. Он является одним из исходных веществ при производстве синтетических каучуков, поливинилхлорида и других полимеров.


Информационные ресурсы http://school-sector.relarn.ru/nsm/chemistry/Rus/Data/Text/Ch3_2.html http://images.google.ru/imglanding http://images.yandex.ru/search О.С.Габриелян «Химия 10класс»