Презентация на тему: Соединения алюминия

Соединения алюминия Урок химии в 9 классе Подготовила учитель химии высш.квал.кат. МОУ «СОШ №8» с. Тищенского Дереглазова Ольга Петровна

Цели урока: обобщить знания об алюминии и его соединениях, опытным путем изучить амфотерность оксида и гидроксида алюминия, уметь составлять уравнения реакций с участием соединений алюминия в свете ТЭД, показать большое практическое значение алюминия и его соединений.

Вопросы для беседы: Положение алюминия в ПСХЭ. Какими химическими свойствами обладает алюминий – простое вещество? Что такое амфотерность? Докажите, что алюминий проявляет амфотерные свойства. Записать уравнения химических реакций с участием алюминия. Можно ли использовать алюминиевую посуду? Приведите аргументы за и против.

«Люди гибнут за металл» В.Гете. 1. Подумайте, почему алюминий так дорого ценился? 2. Какие соединения образует алюминий? 3. Назовите формулы этих соединений.

Лабораторная работа Получение гидроксида алюминия В 2 пробирки налейте по 1 мл раствора соли алюминия. В обе пробирки прилейте по каплям раствор щелочи до появления белого осадка гидроксида алюминия: AlCl3 + 3NaOH Al(OH)3 + 3NaCl

Лабораторная работа Доказательство амфотерности: Опыт1.Взаимодействие с кислотами В одну пробирку с осадком прилейте раствор соляной кислоты. Опыт 2.Взаимодействие со щелочами В другую пробирку с осадком прилейте избыток раствора щелочи

Что наблюдали? Осадки гидроксида алюминия в обеих пробирках растворяются. Вывод: гидроксид алюминия проявляет свойства оснований, взаимодействуя с кислотой, но он также ведет себя и как нерастворимая кислота, взаимодействуя со щелочью, т.е. проявляет амфотерные свойства.

Гидроксид алюминия можно записать как основание и как кислоту

Запишите уравнения реакций: Al(OH)3 + 3HCl = AlCl3 +3H2O H3AlO3 + 3NaOH = Na3AlO3+3H2O

Амфотерность оксида алюминия Al2O3 + 6HCl = 2AlCl3 + 3H2O Al2O3 + 3NaOH = Na3AlO3 + 3H2O

Алюминий в природе 1.Боксит 2.Рубин 3.Каолин

Применение соединений алюминия
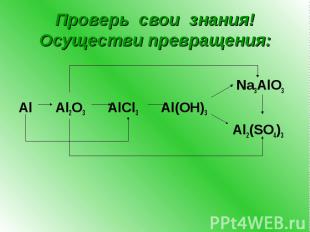
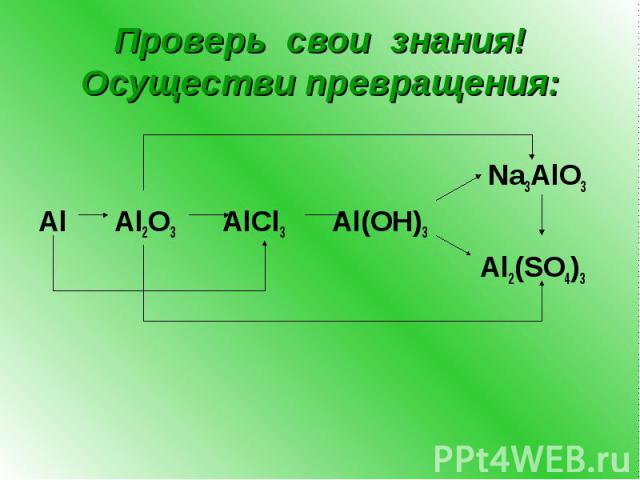
Проверь свои знания! Осуществи превращения: Na3AlO3 Al Al2O3 AlCl3 Al(OH)3 Al2(SO4)3

Совершенно верно!!!