Презентация на тему: Получение солей

Свойства солей. Получение солей 900igr.net

Свойства солей Некоторые физические свойства: все соли – твердые кристаллические вещества.Соли имеют различную окраску. Каждая индивидуальная соль характеризуется строго определенными физическими константами (например температура плавления)

По растворимости в воде 1) растворимые. Это соли щелочных металлов, соли аммония, нитраты и ацетаты, сульфиды бария и магния

2) малорастворимые AgCl, CuCl, Hg2Cl2, PbCl2

3) Нерастворимые все сульфиды, карбонаты, сульфиты, силикаты, фосфаты (кроме солей аммония, щелочных металлов, сульфидов магния и бария)

Химические свойства средних солей 1. Соль1+кислота1 соль2+кислота2 Ряд кислот: HNO3, H2SO4, HCl, H3PO4, H2SO3, H2CO3,H2S, H2SiO3 каждая предыдущая кислота вытесняет из соли следующую

Закончить уравнения Na2SiO3+HCl …; Na2CO3+ H2SO4 …; CuS+ H2SO4(p) …

2. Соль1+щелочь соль2+нерастворимое основание Mg(NO3)2+KOH …; Fe2(SO4)3+NaOH …

3. соль1+металл1 соль2+металл2 CuSO4+Zn …; Hg(NO3)2+Cu … Каждый левостоящий металл вытесняет из соли правостоящий.

4. Соль1+соль2 соль3+соль4 AgNO3+NaCl …; CuSO4+BaCl2 …

Получение солей Средние соли. Металл+неметалл: 2Fe+3Cl2 2FeCl3

2. Металл+кислота соль +водород : Mg+2HCl MgCl2+H2

3. Металл+соль Zn+CuSO4 Cu+ZnSO4

4. Основной оксид+ кислотный оксид CaO+CO2 CaCO3

5. Основной оксид+кислота CuO+H2SO4 CuSO4+H2O

6. Основание+кислотный оксид Ba(OH)2+N2O5 Ba(NO3)2+2H2O

7. Основание+кислота .Fe(OH)3+3HCl FeCl3+3H2O

8. Щелочь+соль 2NaOH+Mg(NO3)2 2NaNO3+Mg(OH)2

9. Соль+кислота CaCO3+2HCl CaCl2+CO2+H2O

10. Соль1+соль2 Na2SO4+AgNO3 2NaNO3+Ag2SO4

При написании уравнений реакций следует помнить 1) Реакция возможна, если в результате реакции образуется а)осадок, б) газ, в)слабый электролит

продолжение 2) Водород из кислот (кроме азотной и концентрированной серной) вытесняют только металлы, стоящте левее водорода в ряду напряжений

продолжение 3) Каждый левостоящий металл (в ряду напряжений) может вытеснять правостоящий из раствора его соли

Получение кислых солей Неполная нейтрализация кислоты основанием . В реакции участвует избыток кислоты и недостаток основания. H3PO4+KOH KH2PO4+H2O H3PO4+2KOH K2HPO4+2H2O

2.Соль средняя+кислота кислая соль CaCO3+CO2+H2O Ca(HCO3)2 Na2SO4+H2SO4 2NaHSO4

Получение основных солей Неполная нейтрализация основания кислотой (избыток основания+недостаток кислоты основная соль). Fe(OH)3+HCl Fe(OH)2Cl Fe(OH)3+2HCl FeOHCl+2H2O

2. Средняя соль1+щелочь основная соль+средняя соль2 FeCl2+KOH FeOHCl+KCl
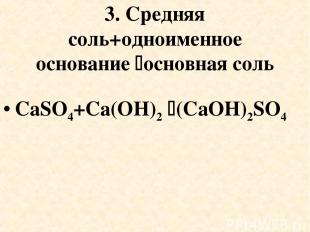
3. Средняя соль+одноименное основание основная соль CaSO4+Cа(OH)2 (CaOH)2SO4

Взаимосвязь средних, кислых, основных солей Кислая соль+основание средняя соль+вода NaHSO3+NaOH Na2SO4+H2O KH2PO4+2KOH K3PO4+2H2O

Основная соль+кислота средняя соль+вода CaOHNO3+HNO3 Ca(NO3)2+H2O Cr(OH)2Cl+2HCl CrCl3+2H2O

Осуществить цепочку превращений Fe FeO FeSO4 Fe(OH)2 Fe(OH)Cl FeCl2 2Fe+O2 2FeO; 2) FeO+H2SO4 FeSO4+H2O;
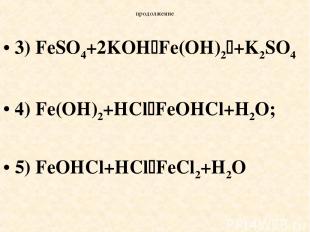
продолжение 3) FeSO4+2KOH Fe(OH)2 +K2SO4 4) Fe(OH)2+HCl FeOHCl+H2O; 5) FeOHCl+HCl FeCl2+H2O

2. P P2O5 H3PO4 KH2PO4 K2HPO4 K3PO4 1)4P+5O2 2 P2O5 2) P2O5+3H2O 2H3PO4; 3) H3PO4+KOH KH2PO4+H2O; 4) KH2PO4+KOH K2HPO4+ H2O 5) K2HPO4+KOH K3PO4 + H2O













































