Презентация на тему: Получение и свойства водорода

Тема урока: 900igr.net

Как вы думаете , где используется водород? Каково практическое значение водорода? Где можно использовать знания по данной теме? Каковы цели урока?

Цели урока: 1.Знать характеристику водорода. 2.Уметь охарактеризовать водород на основе его положения в ПСХЭ, составлять уравнения реакций ( ОВР) на примере химических свойств водорода; делать выводы по теме, систематизировать материал; строить связные высказывания в учебно-научном стиле при работе в группах ; высказывать свою точку зрения, выслушивать мнение своего товарища.

План урока: 1. Применение и значение водорода. 2.Открытие водорода. 3. Двойственное положение водорода в ПСХЭ. 4.Строение атома. 5.Физические свойства водорода 6.Получение водорода. Химические свойства водорода.

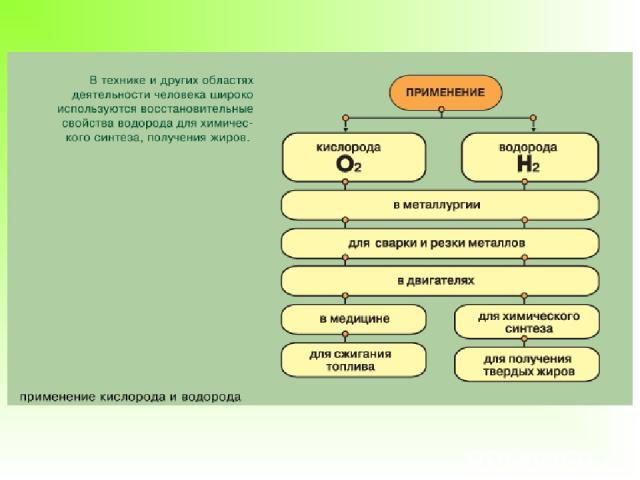
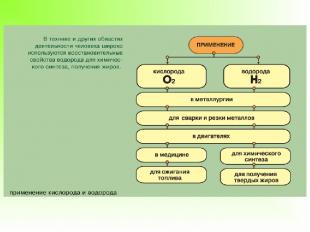
Водород используется для наполнения метеорологических зондов (ранее воздушных шаров и дирижаблей), как топливо в ракетной технике, в кислородно-водородных горелках для сварки и резки металлов. Области применения водорода весьма разнообразны, но все связаны с его восстановительными свойствами. Это производство аммиака и соляной кислоты, получение особо чистых металлов, органический синтез (получение синтетического моторного топлива, гидрогенизация жиров, синтез анилина из нитробензола). Дейтерий и тритий используют в процессах термоядерного синтеза.


Водород входит в состав основного вещества Земли - воды.

Среди общего числа атомов, образующих Солнце, на водород приходится около 84%.

Водород - самый распространенный элемент в космосе. Основная масса звезд состоит из водорода, он преимущественно составляет межзвездное вещество.

Водород был открыт английским химиком Г. Кавендишем в 1766 г. Он относится к довольно распространенным элементам (в земной коре примерно 1 % по массе) и встречается в природе в свободном состоянии (верхние слои атмосферы, газ при извержениях вулканов) и в виде соединений (вода, нефть, органические вещества). В свободном виде встречается редко.

Водород, водород – элемент наоборот! От щелочных металлов не отстал и И к галогенам не пристал!
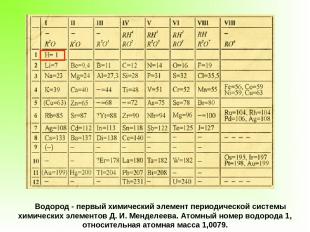
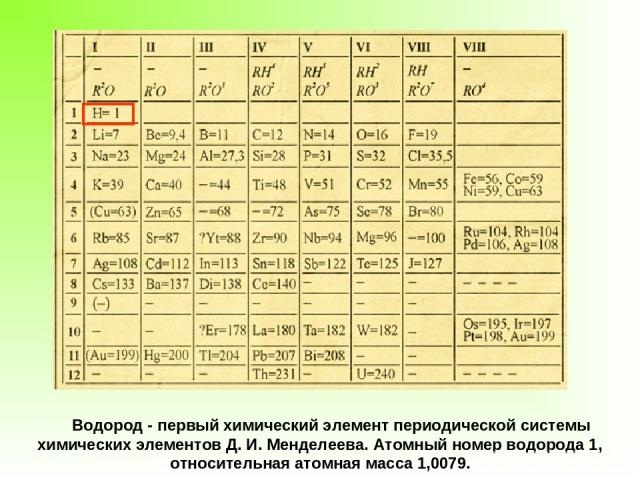
Водород - первый химический элемент периодической системы химических элементов Д. И. Менделеева. Атомный номер водорода 1, относительная атомная масса 1,0079.

Водород- легчайший газ, У него мельчайший атом. Водород на первом месте В менделеевской системе.

СТРОЕНИЕ АТОМА ВОДОРОДА



ВЫВОД: строение обусловливает разнообразие свойств водорода, его двойственное положение в системе Д. И. Менделеева — в I и VII группах.

При обычных условиях водород - газ без цвета и запаха, почти в 15 раз легче воздуха. Обладает очень высокой теплопроводностью, сравнимой с теплопроводностью металлов. Это происходит из-за легкости молекул водорода и, следовательно, большой скорости их движения. Водород хорошо растворяется в некоторых металлах: в одном объеме палладия, например, растворяется 900 объемов водорода.

Видефрагмент « Мыльные пузыри» мыльные пузыри.wmv

Видеофрагмент « Нерастворимость водорода в воде» нерастворимость вод. в воде.wmv

Получение водорода в лаборатории получение водорода.wmv

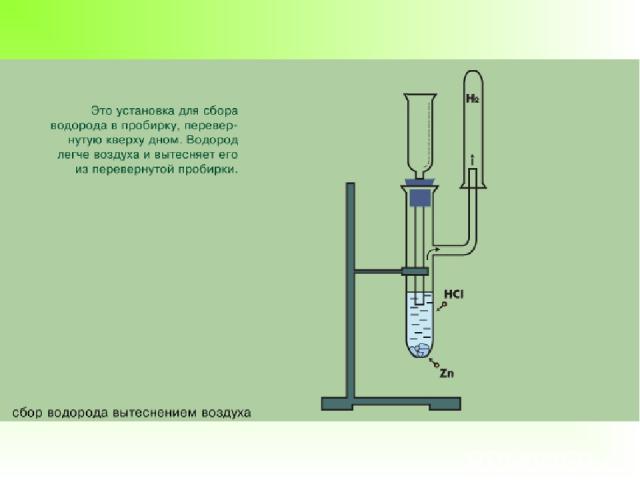
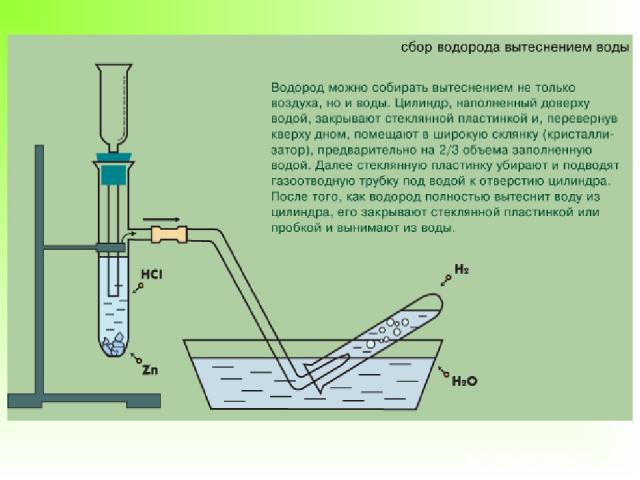
Получение водорода В лаборатории. 1. Действием на металлы (обычно цинк) соляной или разбавленной серной кислотой: Zn + H2SO4 = ZnSO4 + H2 2. Взаимодействием паров воды с раскаленными железными стружками: 4H2O + 3Fe = Fe3O4 + 4H2 В промышленности. 1. Конверсией метана парами воды: CH4 + 2H2O = 4H2 + CO2 2. Конверсией оксида углерода: СО + H2O = CO2 + H2 3. Термическим разложением метана: СН4 = С + 2Н2 4. Электролизом воды. Получаемый водород чистый, но очень дорогой.

А что произойдет , если в реку бросить кусок натрия? http://www.youtube.com/watch?v=2mxR9An_7EU&NR=1
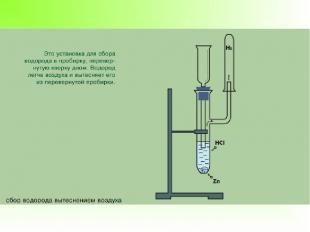
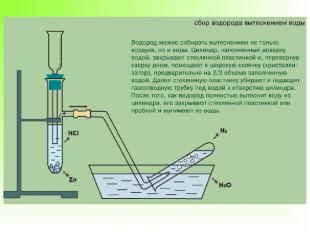

Работа по группам А)« Получение водорода методом вытеснения воздуха» ( 1 группа) Б)« Получение водорода методом вытеснения воды» ( 2 группа) В) Получение водорода в промышленности. ( 3 группа). Г)4 группа готовит сообщение об открытии водорода.

Смесь 2 объемов Н2 и 1 объема О2 называется гремучим газом

Не шутите с Водородом! Он горит , рождая воду, В смеси с Кислородом- братом Он взрывается , ребята! Вам скажу на всякий случай – Эту смесь зовут « гремучей».

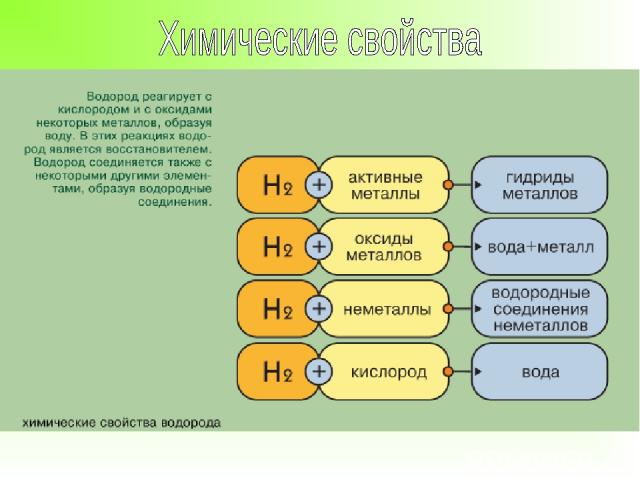
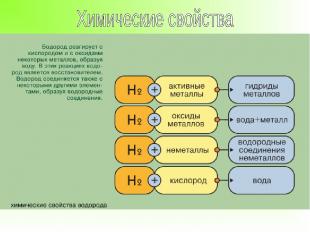
ВЫВОД: с металлами водород является окислителем ( как галогены), а с неметаллами и со сл. веществами– восстановителем ( как ЩМ).

ЗАКРЕПЛЕНИЕ ЗНАНИЙ 1 -3 группы – тестирование на ПК адрес индивидуального задания в компьютере: «Рабочий стол-папка «Химия 9 класс»-документ «водород-тесты» 4 группа- оформляет плакат по теме « А знаете ли вы ? » с использованием загадок , поговорок про водород.

Домашнее задание Изучить параграф 17, упр.1-4 Составить буклет или презентацию по теме: « Галогены».