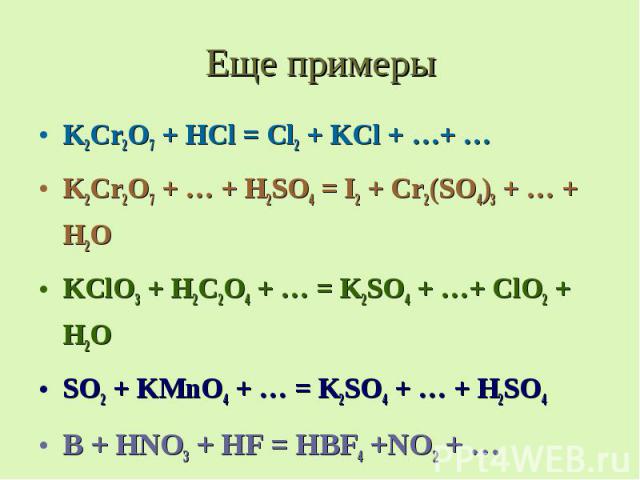Презентация на тему: Обзор заданий блока «С»

Обзор заданий блока «С»

Окислительно-восстановительные реакции. Электронный баланс

Окислительно-восстановительные реакции (1) Используя метод электронного баланса, составьте уравнение реакции: Cr2(SO4)3 + … + NaOH = = Na2CrO4 + NaBr + … + H2O Определите окислитель и восстановитель.

Окислительно-восстановительные реакции Cr2(SO4)3 + Br2 + NaOH = = Na2CrO4 + NaBr + Na2SO4+ H2O 2 Cr+3 – 3e- → Cr+6 окисление 3 Br2 + 2e- → 2Br -1 восстановление Br2 ─ окислитель Cr3+ ─ восстановитель

Равновесие между хроматами и дихроматами Дихроматы в кислой среде – сильные окислители. При взаимодействии дихромата в кислой среде с пероксидом водорода Образуются надхромовые кислоты H2CrO6.
![Окисление Cr(III) в Cr(VI) [Cr(OH)6]3- + 3 H2O2 = CrO42– + 2OH- + 8H2O В пробирк Окисление Cr(III) в Cr(VI) [Cr(OH)6]3- + 3 H2O2 = CrO42– + 2OH- + 8H2O В пробирк](https://fs1.ppt4web.ru/images/17985/105095/310/img5.jpg)
Окисление Cr(III) в Cr(VI) [Cr(OH)6]3- + 3 H2O2 = CrO42– + 2OH- + 8H2O В пробирку вносят 2-3 капли раствора соли хрома(III). Прибавьте 4-5 капель 2 М раствора NaOH, 2 капли 30%-ного раствора Н2О2 и нагреть до изменения окраски с зеленой на желтую. Раствор сохраните для следующего опыта. Желтый раствор, полученный в предыдущем опыте, нагрейте до кипения, Охладите под струей холодной воды, прибавьте 5 капель раствора H2O2, Примерно 0,5 мл амилового спирта, тщательно перемешайте и прибавляйте По каплям раствор H2SO4 (1 моль/л). Верхний органический слой окрашивается в интенсивно синий цвет.

Окислительно-восстановительные реакции Используя метод электронного баланса, составьте уравнение реакции: Si + HNO3 + HF = = H2SiF6 + NO + … Определите окислитель и восстановитель.

Окислительно-восстановительные реакции Si + HNO3 + HF = = H2SiF6 + NO + H2O 3 Si0 – 4e- → Si+4 окисление 4 N+5 + 3e- → N+2 восстановление HNO3 ─ окислитель Si ─ восстановитель

Еще примеры K2Cr2O7 + HCl = Cl2 + KCl + …+ … K2Cr2O7 + … + H2SO4 = I2 + Cr2(SO4)3 + … + H2O KClO3 + H2C2O4 + … = K2SO4 + …+ ClO2 + H2O SO2 + KMnO4 + … = K2SO4 + … + H2SO4 B + HNO3 + HF = HBF4 +NO2 + …

Генетическая связь между классами неорганических веществ

Образцы заданий (неорг) Даны вещества: магний, азот, аммиак, азотная кислота (разб.). Напишите уравнения четырех возможных реакций между этими веществами. Ca, P, HNO3 Na2SO3, H2O, KOH, KMnO4, H3PO4. Cu, HNO3, CuS, NO

Cu, HNO3, CuS, NO

Цепочки Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

Решение по Cr

Генетическая связь между классами органических веществ
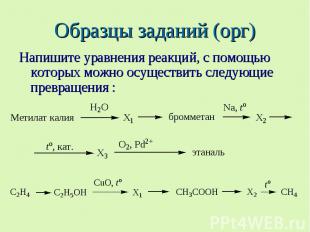
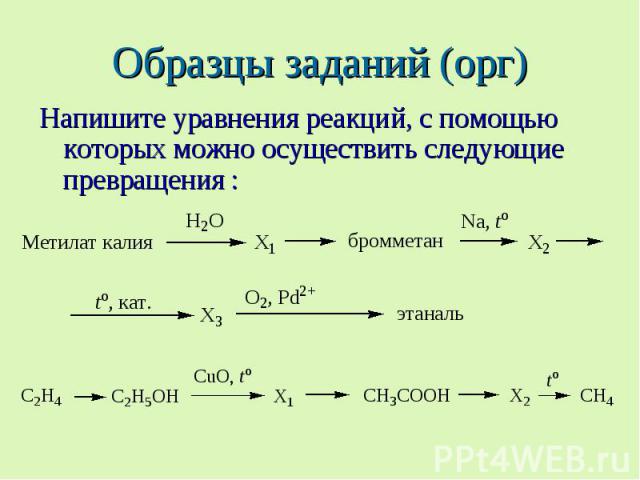
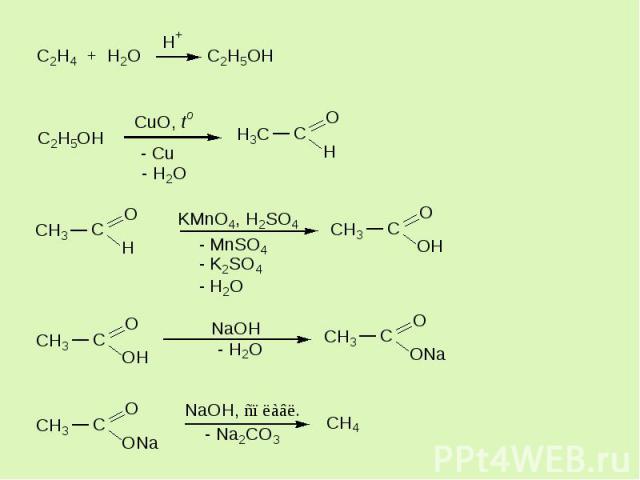
Образцы заданий (орг) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения :
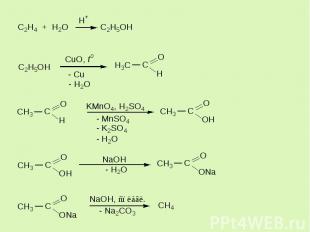

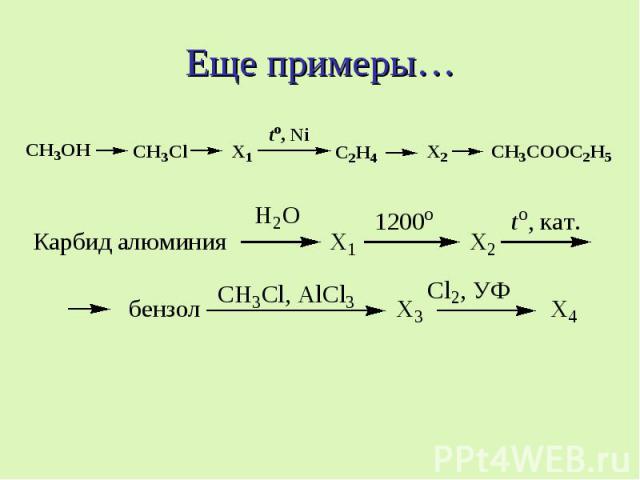
Еще примеры…

Задача по теме «Растворы»

Примеры заданий К 1170 г 0,5% раствора хлорида натрия прилили 1275 г 0,2%-ного раствора нитрата серебра. Какова массовая доля нитрата натрия в полученном растворе? Для получения раствора сульфата калия рассчитанное количество карбоната калия растворили в 5%-ной серной кислоте. Определите массовую долю сульфата калия в полученном растворе.

Примеры заданий Хлор без остатка прореагировал с 228,58 мл 5%-ного раствора NaOH (плотность 1,05 г/мл) при повышенной температуре. Определите состав полученного раствора и рассчитайте массовые доли веществ в этом растворе. Медь массой 6,4 г обработали 100 мл 30%-ным раствором азотной кислоты (ρ=1,153 г/мл). Для полного связывания продуктов к полученному раствору добавили 200 г раствора гидроксида натрия. Определите массовую долю щелочи в использованном растворе.

Задача на вывод формул

Примеры заданий При термическом разложении вещества образовалось 16 г CuO, 18,4 г NO2 и 2,24 л кислорода (н.у.). Определите формулу вещества, если его молярная масса равна 188 г/моль. Предельную одноосновную кислоту массой 11 г растворили в воде. Для нейтрализации полученного раствора потребовалось 25 мл раствора гидроксида натрия, молярная концентрация которого 5 моль/л. Определите формулу кислоты.

Разберем задачу… При полном сжигании вещества, не содержащего кислорода, образуются азот и вода. Относительная плотность паров этого вещества по водороду равна 16. Объем необходимого на сжигание кислорода равен объему выделившегося азота. Определите молекулярную формулу соединения.

Решение По уравнению реакции x = 0,5y, то есть y = 2x С учетом относительных атомных масс азота и водорода составим и решим уравнение:

Спасибо за внимание! Пора пить чай или кофе…






![Окисление Cr(III) в Cr(VI) [Cr(OH)6]3- + 3 H2O2 = CrO42– + 2OH- + 8H2O В пробирку вносят 2-3 капли раствора соли хрома(III). Прибавьте 4-5 капель 2 М раствора NaOH, 2 капли 30%-ного раствора Н2О2 и нагреть до изменения окраски с зеленой на желтую. Р… Окисление Cr(III) в Cr(VI) [Cr(OH)6]3- + 3 H2O2 = CrO42– + 2OH- + 8H2O В пробирку вносят 2-3 капли раствора соли хрома(III). Прибавьте 4-5 капель 2 М раствора NaOH, 2 капли 30%-ного раствора Н2О2 и нагреть до изменения окраски с зеленой на желтую. Р…](https://fs1.ppt4web.ru/images/17985/105095/640/img5.jpg)