Презентация на тему: История изучения структуры белка

Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру белков. Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру белков. Позднее Уолтер Каузман внёс весомый вклад в понимание законов образования третичной структуры белков и роли в этом процессе гидрофобных взаимодействий. В 1949 году Фред Сенгер определил аминокислотную последовательность инсулина, продемонстрировав таким способом, что белки — это линейные полимеры аминокислот, а не их разветвлённые (как у некоторых сахаров) цепи. Первые структуры белков, основанные на дифракции рентгеновских лучей на уровне отдельных атомов были получены в 1960-х годах и с помощью ЯМР в 1980-х годах. В 2006 году Банк данных о белках (Protein Data Bank) содержал около 40 000 структур белков.

В XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные белки, но и одновременное изменение количества и пост трансляционные модификации большого числа белков отдельных клеток, тканей или организмов. Эта область биохимии называется протеомикой. В XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные белки, но и одновременное изменение количества и пост трансляционные модификации большого числа белков отдельных клеток, тканей или организмов. Эта область биохимии называется протеомикой. С помощью методов биоинформатики стало возможно не только обработать данные рентгенно-структурного анализа, но и предсказать структуру белка, основываясь на его аминокислотной последовательности. В настоящее время электронная микроскопия больших белковых комплексов и предсказание малых белков и доменов больших белков с помощью компьютерных программ по точности приближаются к разрешению структур на атомном уровне.

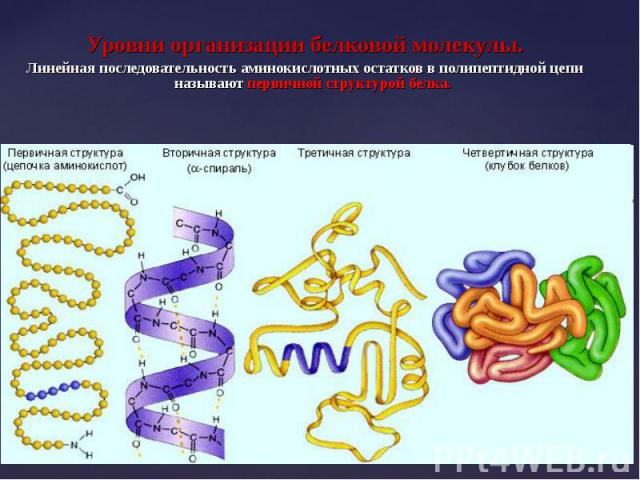
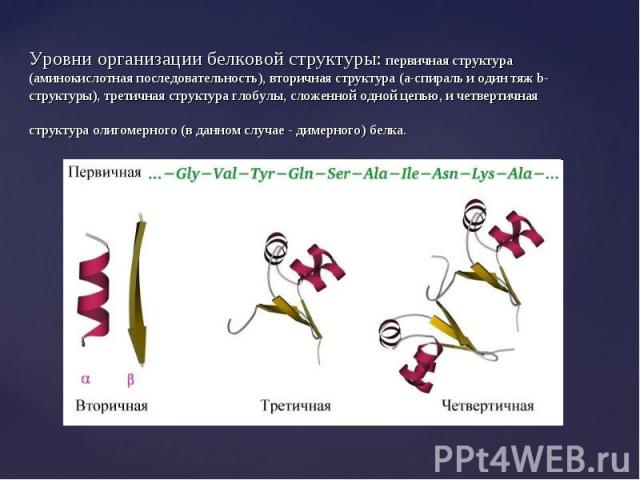
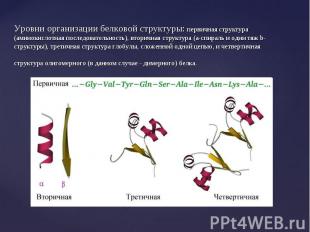
Молекулы белка трехмерны и имеют несколько уровней организации. Молекулы белка трехмерны и имеют несколько уровней организации. Первичная структура – порядок чередования (последовательность) аминокислот в полипептидной цепи, соединенных между собой пептидными связями. Первичная структура индивидуальна для различных белков.

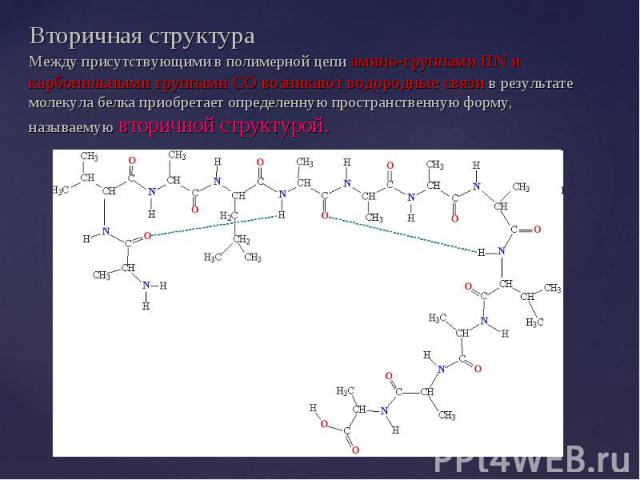
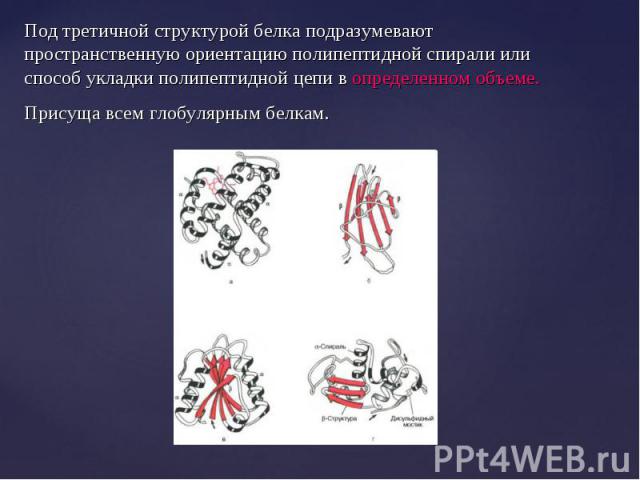
Линейные полипептидные цепи белков за счет взаимодействия функциональных групп аминокислот приобретают определенную пространственную структуру, называемую «конформация». Линейные полипептидные цепи белков за счет взаимодействия функциональных групп аминокислот приобретают определенную пространственную структуру, называемую «конформация». Все молекулы белков, имеющих одинаковую первичную структуру имеют одинаковую конформацию. В белках различают 2 основных типа конформации полипептидных цепей: вторичную и третичную структуры.
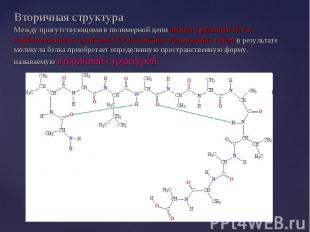


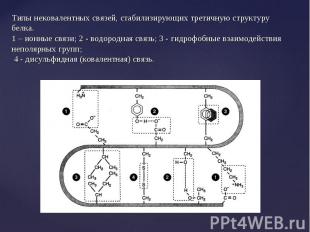
В результате стягивающего действия водородных связей молекула приобретает форму спирали – так называемая a-спираль, ее изображают в виде изогнутой спиралевидной ленты, проходящей через атомы, образующие полимерную цепь. В результате стягивающего действия водородных связей молекула приобретает форму спирали – так называемая a-спираль, ее изображают в виде изогнутой спиралевидной ленты, проходящей через атомы, образующие полимерную цепь. a-спираль представляет собой самый жесткий тип вторичной структуры , преобладает во многих белках.
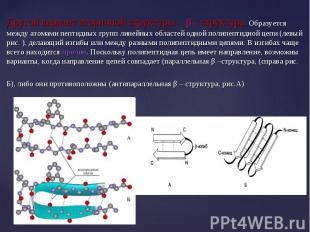

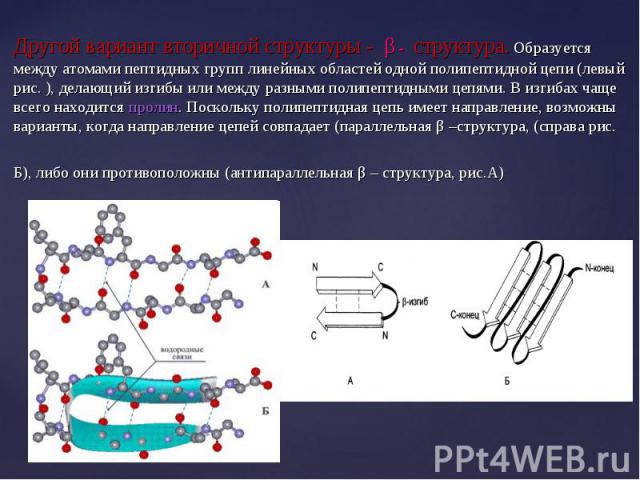
β-структура (по Березову Т.Т.) – складчатый тип, водородные связи формируют гофрированную структуру из полипептидной цепи. На схемах изображается в виде стрелки от N к С – концу. β-структура (по Березову Т.Т.) – складчатый тип, водородные связи формируют гофрированную структуру из полипептидной цепи. На схемах изображается в виде стрелки от N к С – концу.
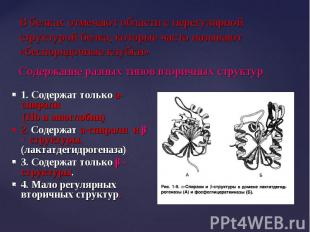
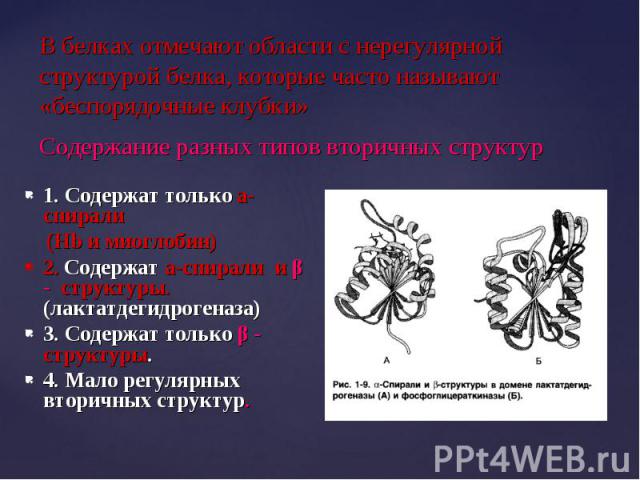
1. Содержат только a- спирали 1. Содержат только a- спирали (Hb и миоглобин) 2. Содержат a-спирали и β - структуры. (лактатдегидрогеназа) 3. Содержат только β - структуры. 4. Мало регулярных вторичных структур.

Специфический порядок формирования вторичных структур называют супервторичной структурой белка. Специфический порядок формирования вторичных структур называют супервторичной структурой белка. Различают: тип a/β – бочонка, «цинковый палец», лейциновая застежка и др.
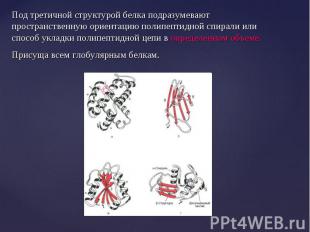



Модель третичной структуры молекулы миоглобина (по Дж. Кендрью). Латинскими буквами обозначены структурные домены, красным цветом – гем Модель третичной структуры молекулы миоглобина (по Дж. Кендрью). Латинскими буквами обозначены структурные домены, красным цветом – гем

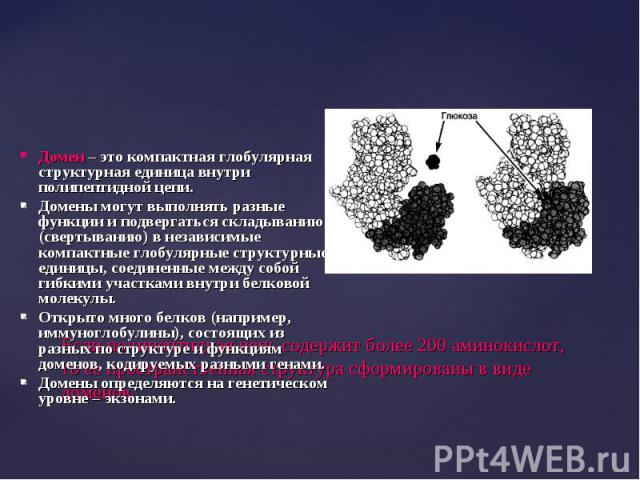
Домен – это компактная глобулярная структурная единица внутри полипептидной цепи. Домен – это компактная глобулярная структурная единица внутри полипептидной цепи. Домены могут выполнять разные функции и подвергаться складыванию (свертыванию) в независимые компактные глобулярные структурные единицы, соединенные между собой гибкими участками внутри белковой молекулы. Открыто много белков (например, иммуноглобулины), состоящих из разных по структуре и функциям доменов, кодируемых разными генами. Домены определяются на генетическом уровне – экзонами.


Каждая отдельно взятая полипептидная цепь, получившая название протомера, мономера или субъединицы, чаще всего не обладает биологической активностью. Каждая отдельно взятая полипептидная цепь, получившая название протомера, мономера или субъединицы, чаще всего не обладает биологической активностью. Эту способность белок приобретает при определенном способе пространственного объединения входящих в его состав протомеров, т.е. возникает новое качество, не свойственное мономерному белку. Образовавшуюся молекулу принято называть олигомером.
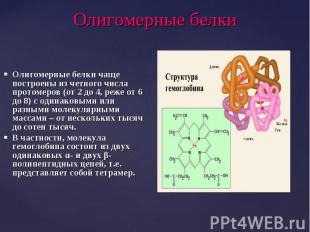
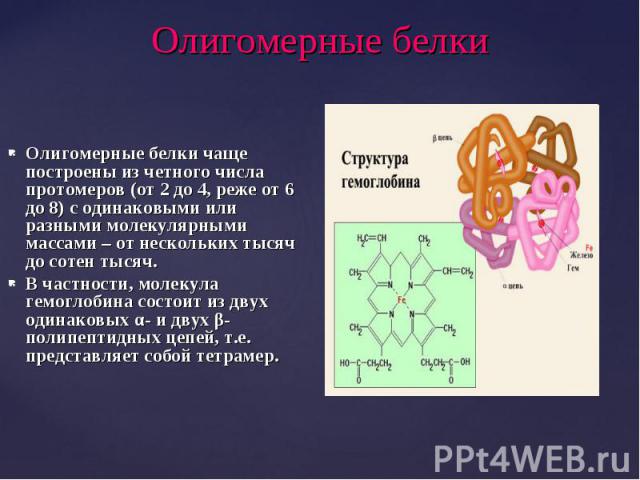
Олигомерные белки чаще построены из четного числа протомеров (от 2 до 4, реже от 6 до 8) с одинаковыми или разными молекулярными массами – от нескольких тысяч до сотен тысяч. Олигомерные белки чаще построены из четного числа протомеров (от 2 до 4, реже от 6 до 8) с одинаковыми или разными молекулярными массами – от нескольких тысяч до сотен тысяч. В частности, молекула гемоглобина состоит из двух одинаковых α- и двух β-полипептидных цепей, т.е. представляет собой тетрамер.
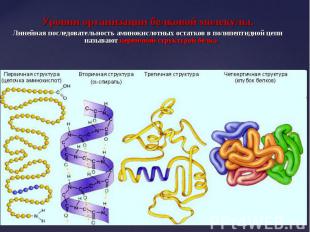
Уровни организации белковой молекулы. Уровни организации белковой молекулы. Линейная последовательность аминокислотных остатков в полипептидной цепи называют первичной структурой белка.




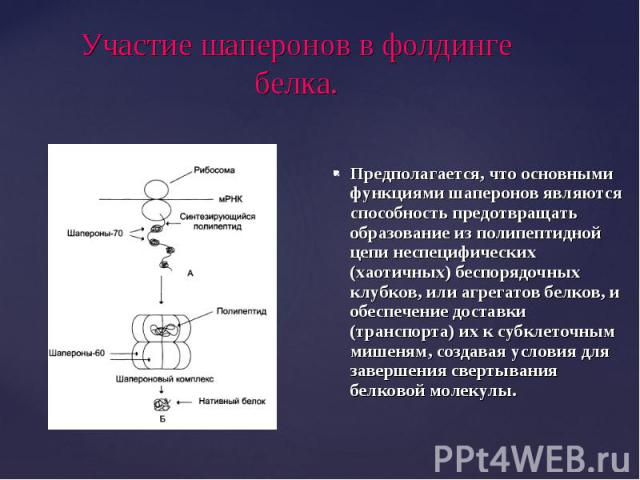
Предполагается, что основными функциями шаперонов являются способность предотвращать образование из полипептидной цепи неспецифических (хаотичных) беспорядочных клубков, или агрегатов белков, и обеспечение доставки (транспорта) их к субклеточным мишеням, создавая условия для завершения свертывания белковой молекулы. Предполагается, что основными функциями шаперонов являются способность предотвращать образование из полипептидной цепи неспецифических (хаотичных) беспорядочных клубков, или агрегатов белков, и обеспечение доставки (транспорта) их к субклеточным мишеням, создавая условия для завершения свертывания белковой молекулы.
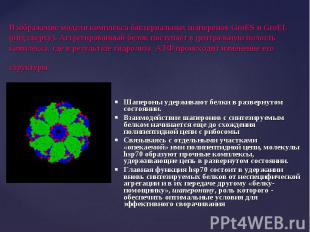
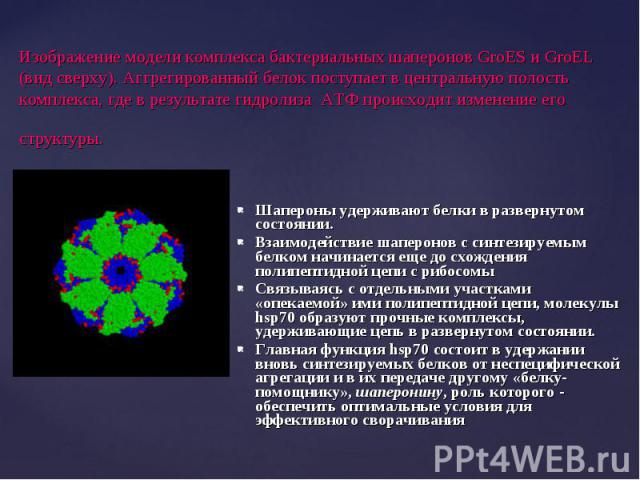
Шапероны удерживают белки в развернутом состоянии. Взаимодействие шаперонов с синтезируемым белком начинается еще до схождения полипептидной цепи с рибосомы Связываясь с отдельными участками «опекаемой» ими полипептидной цепи, молекулы hsp70 образуют прочные комплексы, удерживающие цепь в развернутом состоянии. Главная функция hsp70 состоит в удержании вновь синтезируемых белков от неспецифической агрегации и в их передаче другому «белку-помощнику», шаперонину, роль которого - обеспечить оптимальные условия для эффективного сворачивания

Вновь синтезированный белок или полипептид не всегда функционально активны и требуют дополнительных преобразований, включающих: Вновь синтезированный белок или полипептид не всегда функционально активны и требуют дополнительных преобразований, включающих: Фолдинг молекул. Образование дисульфидных мостиков между остатками цистеина. Частичный протеолиз. Присоединение простетической группы. Сборка протомеров в олигомерный белок. Модификацию аминокислотных остатков: фосфорилирование, гидроксилирование и другие реакции.