Презентация на тему: ионная связь

Химическая связь 11 класс

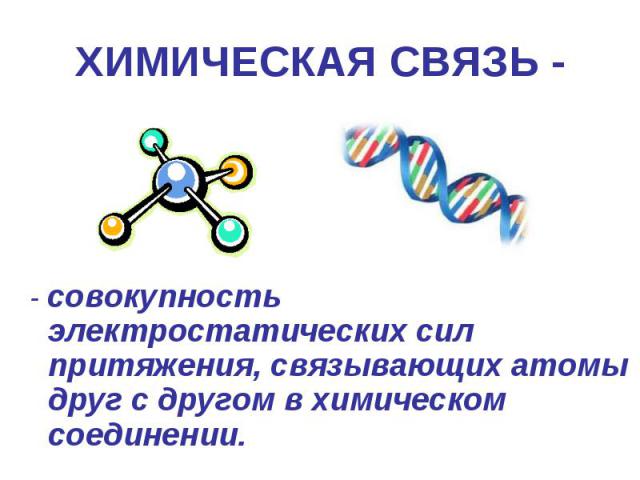
ХИМИЧЕСКАЯ СВЯЗЬ - сила, связывающая атомы в молекулы или другие частицы.
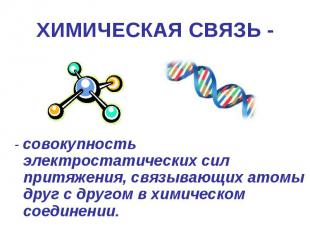
ХИМИЧЕСКАЯ СВЯЗЬ - - совокупность электростатических сил притяжения, связывающих атомы друг с другом в химическом соединении.
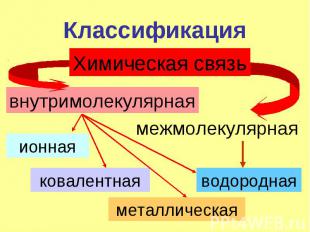
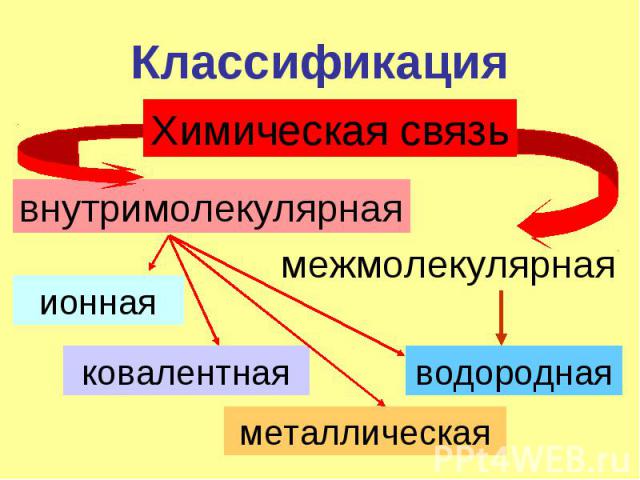
Классификация
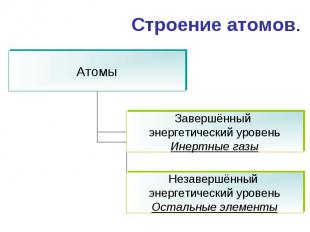
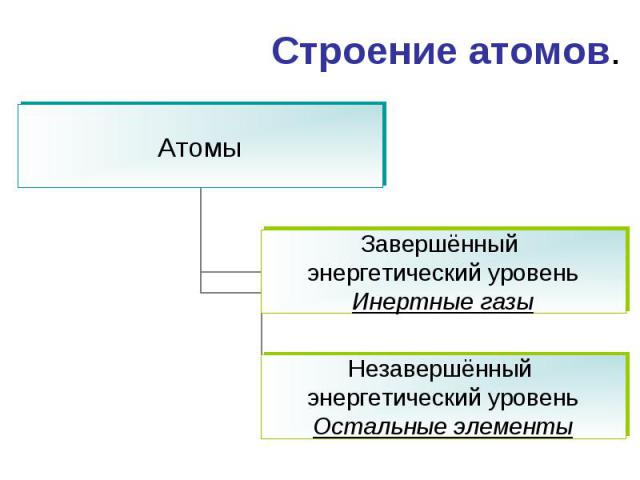
Строение атомов.
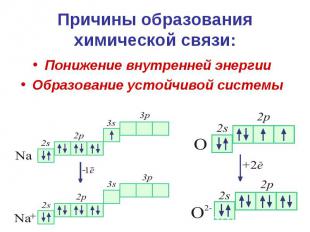
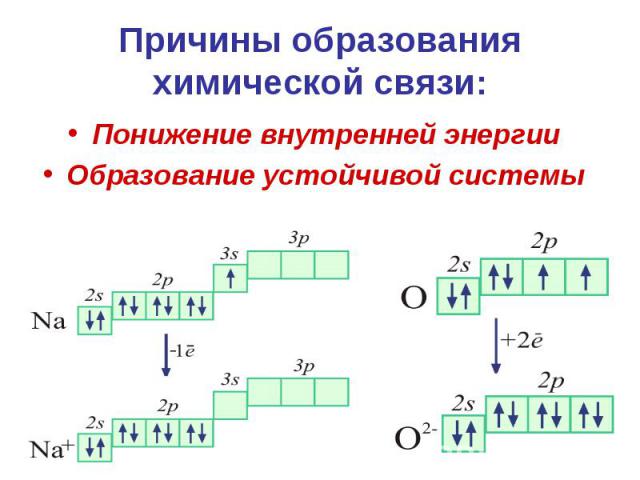
Причины образования химической связи: Понижение внутренней энергии Образование устойчивой системы

Ионная связь -связь, образующаяся между ионами противоположного знака в результате электростатического притяжения.

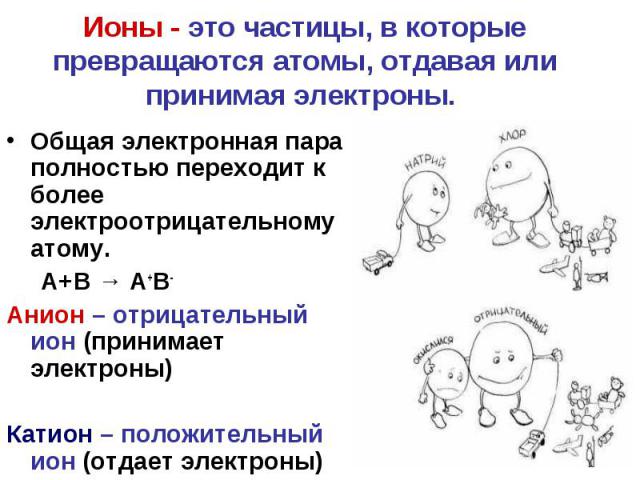
Ионы - это частицы, в которые превращаются атомы, отдавая или принимая электроны. Общая электронная пара полностью переходит к более электроотрицательному атому. А+В → А+В- Анион – отрицательный ион (принимает электроны) Катион – положительный ион (отдает электроны)

Электроотрицательность (ЭО) Электроотрицательность (ЭО)- это способность атома смещать к себе общую электронную пару ОЭО Li = 1

Ионная связь образуется между типичными Ме и НеМ Δ ОЭО элементов ≥ 1,7

Ионные соединения 1. Бинарные соединения типичных металлов и неметаллов; 2. Соли кислородсодержащих кислот; 3. Щёлочи; 4.Соли аммония NH4Cl, (NH4)2SO4 др.; 5. Соли аминов [СН3NH3]+Cl- и др.
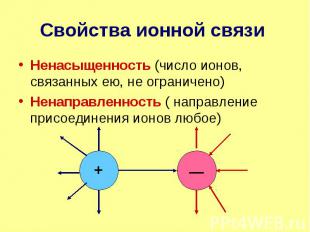
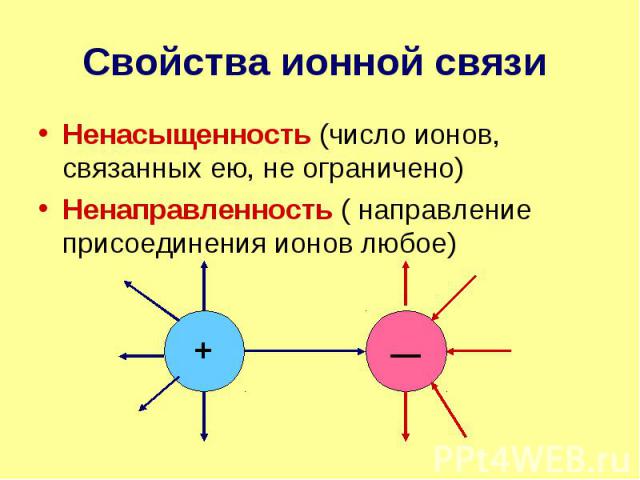
Свойства ионной связи Ненасыщенность (число ионов, связанных ею, не ограничено) Ненаправленность ( направление присоединения ионов любое)

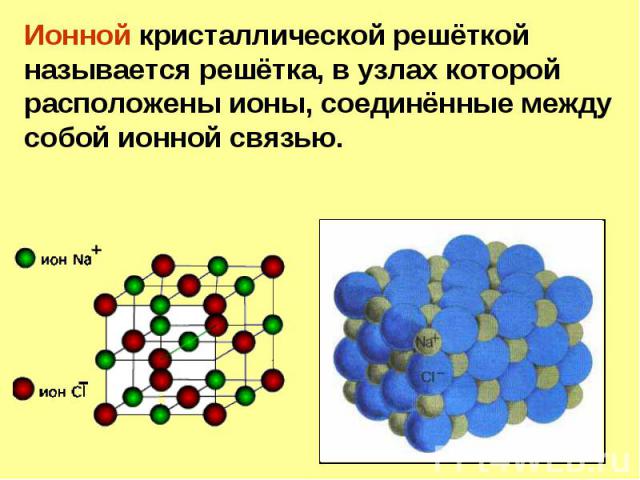
Ионные соединения.



Кристаллические тела – характеризуются пространственной периодичностью в расположении равновесных положений атомов или молекул, при чем эта периодичность выполняется как для малых, так и на больших расстояниях. Кристаллические тела – характеризуются пространственной периодичностью в расположении равновесных положений атомов или молекул, при чем эта периодичность выполняется как для малых, так и на больших расстояниях. В кристаллических телах реализуется как дальний, так и ближний порядок.
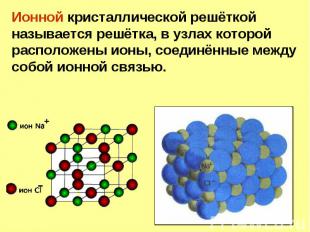

Свойства ионных соединений

Домашнее задание. Габриелян Химия 11 базовый уровень: § 3 вопросы 1,3,4,5,7,8 + 9 письменно Габриелян, Лысова Химия 11 § 6 стр. 44 – 46. приведите примеры веществ с ионной связью.






![Ионные соединения 1. Бинарные соединения типичных металлов и неметаллов; 2. Соли кислородсодержащих кислот; 3. Щёлочи; 4.Соли аммония NH4Cl, (NH4)2SO4 др.; 5. Соли аминов [СН3NH3]+Cl- и др. Ионные соединения 1. Бинарные соединения типичных металлов и неметаллов; 2. Соли кислородсодержащих кислот; 3. Щёлочи; 4.Соли аммония NH4Cl, (NH4)2SO4 др.; 5. Соли аминов [СН3NH3]+Cl- и др.](https://fs1.ppt4web.ru/images/95390/135143/640/img10.jpg)