Презентация на тему: Взаимосвязь между классами неорганических соединений






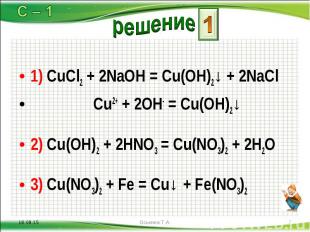
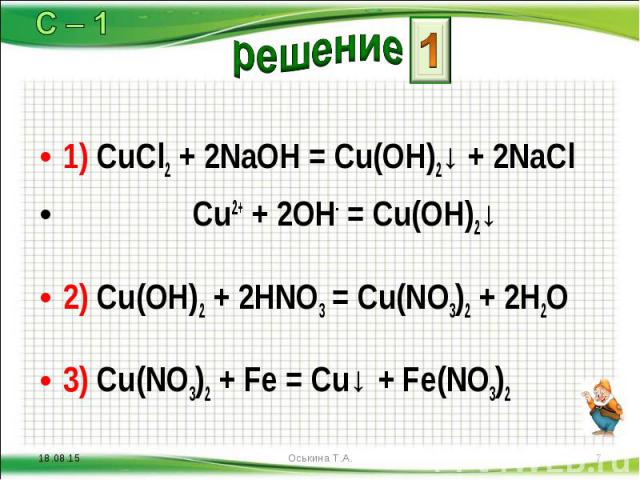
1) CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl 1) CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl Cu2+ + 2OH- = Cu(OH)2↓ 2) Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O 3) Cu(NO3)2 + Fe = Cu↓ + Fe(NO3)2

1) Fe2(SO4)3 +6NaOH =2Fe(OH)3↓+ 3Na2SO4 1) Fe2(SO4)3 +6NaOH =2Fe(OH)3↓+ 3Na2SO4 Fe3+ + 6OH- = 2Fe(OH)3 ↓ 2) 2Fe(OH)3 = Fe2O3 + 3H2O (при нагревании) 3) Fe2O3 + 3CO = 2Fe + 3CО2↑ (при нагревании; в качестве восстановителя могут быть использованы Н2, Al и др.)
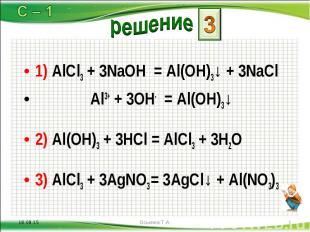
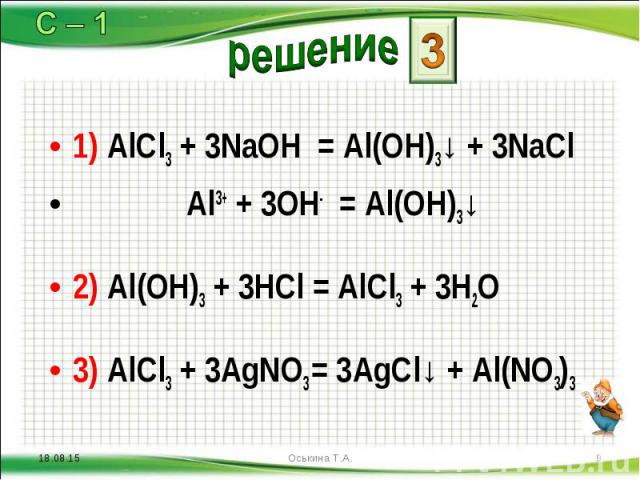
1) AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl 1) AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl Al3+ + 3OH- = Al(OH)3↓ 2) Al(OH)3 + 3HCl = AlCl3 + 3H2O 3) AlCl3 + 3AgNO3 = 3AgCl↓ + Al(NO3)3

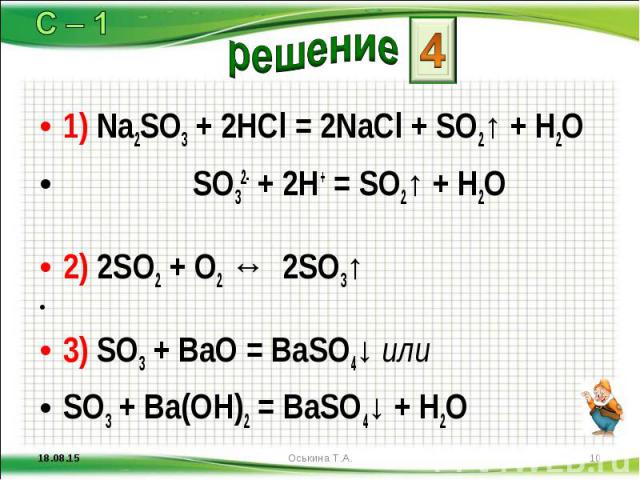
1) Na2SO3 + 2HCl = 2NaCl + SO2↑ + H2O 1) Na2SO3 + 2HCl = 2NaCl + SO2↑ + H2O SO32- + 2H+ = SO2↑ + H2O 2) 2SO2 + O2 ↔ 2SO3↑ 3) SO3 + BaO = BaSO4↓ или SO3 + Ba(OH)2 = BaSO4↓ + H2O
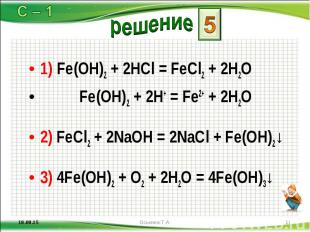
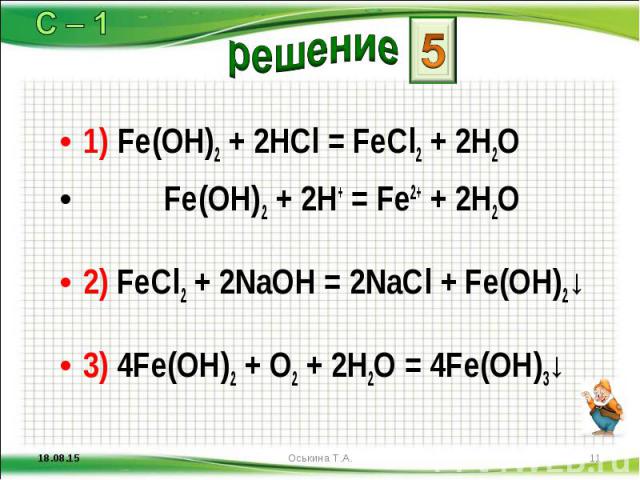
1) Fe(OH)2 + 2HCl = FeCl2 + 2H2O 1) Fe(OH)2 + 2HCl = FeCl2 + 2H2O Fe(OH)2 + 2H+ = Fe2+ + 2H2O 2) FeCl2 + 2NaOH = 2NaCl + Fe(OH)2↓ 3) 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3↓

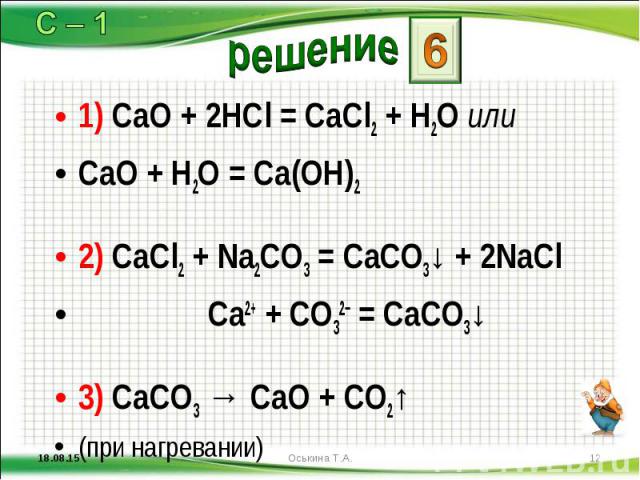
1) CaO + 2HCl = CaCl2 + H2O или 1) CaO + 2HCl = CaCl2 + H2O или CaO + H2O = Ca(OH)2 2) CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl Ca2+ + CO32− = CaCO3↓ 3) CaCO3 → CaO + CO2↑ (при нагревании)

1) Zn + 2HCl = ZnCl2 + H2↑ 1) Zn + 2HCl = ZnCl2 + H2↑ 2) ZnCl2 + 2NaOH = Zn(OH)2↓ + 2NaCl Zn2+ + 2OH- = Zn(OH)2↓ 3) Zn(OH)2 = ZnO + H2O (нагревание)
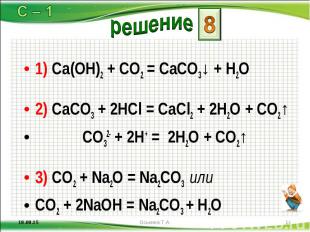
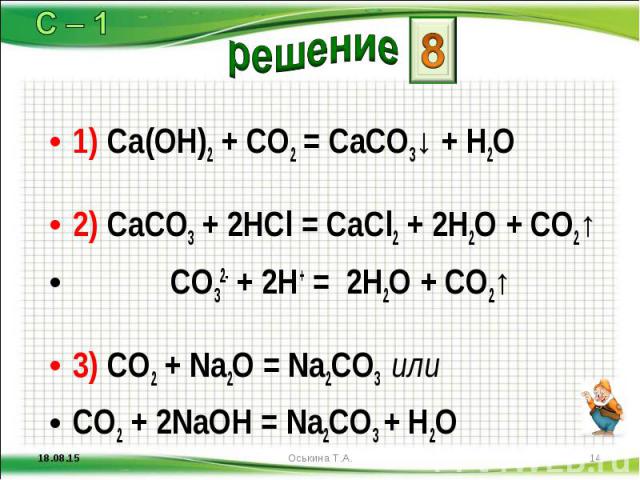
1) Ca(OH)2 + CO2 = CaCO3↓ + H2O 1) Ca(OH)2 + CO2 = CaCO3↓ + H2O 2) CaCO3 + 2HCl = CaCl2 + 2H2O + CO2↑ CO32- + 2H+ = 2H2O + CO2↑ 3) CO2 + Na2O = Na2CO3 или CO2 + 2NaOH = Na2CO3 + H2O
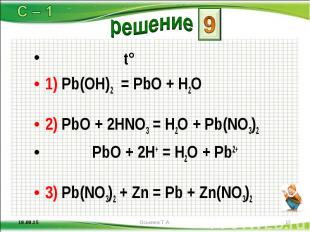
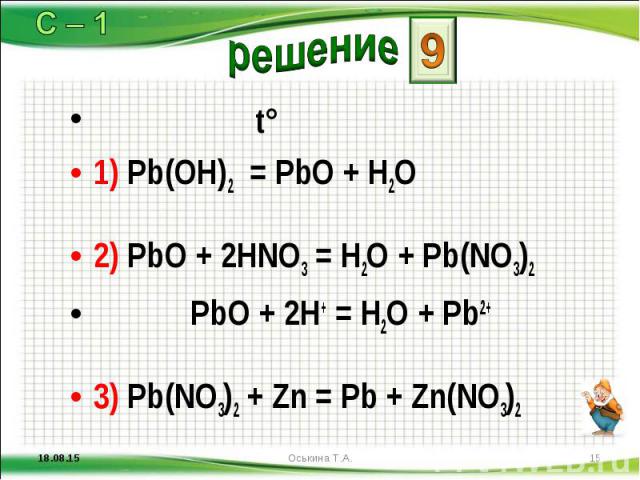
t° t° 1) Pb(OH)2 = PbО + H2O 2) PbО + 2НNO3 = H2O + Pb(NO3)2 PbО + 2Н+ = H2O + Pb2+ 3) Pb(NO3)2 + Zn = Pb + Zn(NO3)2

1) 2Na + 2H2O = 2NaOH + H2↑ 1) 2Na + 2H2O = 2NaOH + H2↑ 2) 2NaOH + SO2 = Na2SO3 + H2O 2OH- + SO2 = SO32- + H2O 3) Na2SO3 + BaCl2 = BaSO3 + 2NaCl
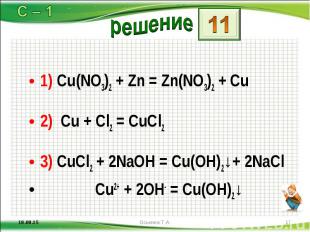
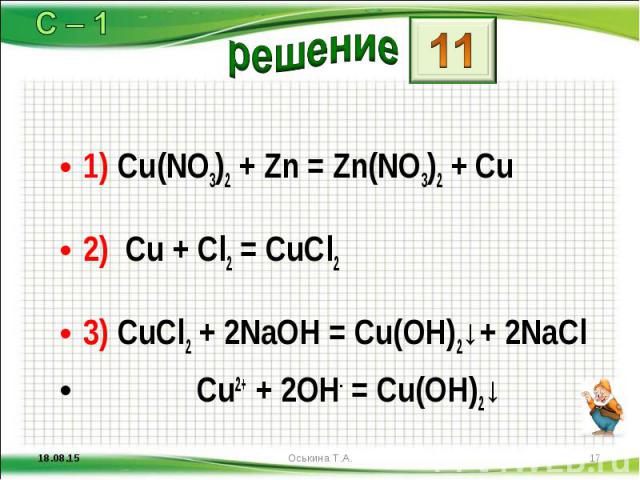
1) Cu(NО3)2 + Zn = Zn(NО3)2 + Сu 1) Cu(NО3)2 + Zn = Zn(NО3)2 + Сu 2) Сu + Сl2 = СuСl2 3) СuСl2 + 2NaOH = Сu(ОН)2↓+ 2NaCl Cu2+ + 2OH- = Cu(OH)2↓
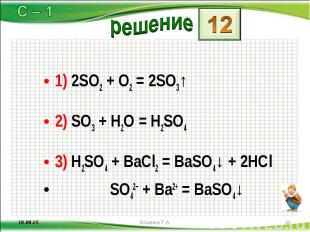
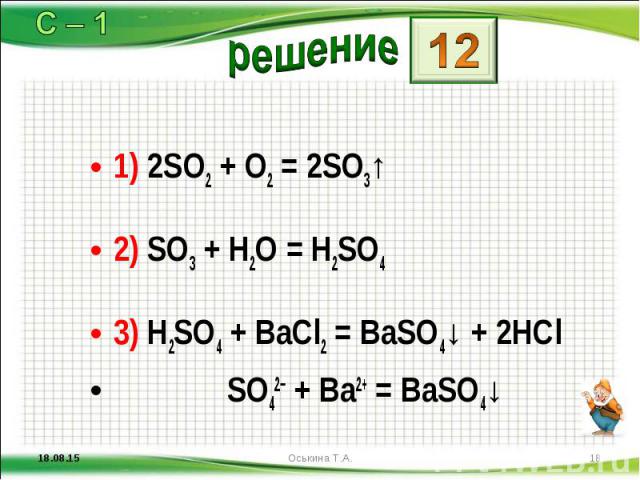
1) 2SO2 + O2 = 2SO3↑ 1) 2SO2 + O2 = 2SO3↑ 2) SO3 + H2O = H2SO4 3) H2SO4 + BaCl2 = BaSO4↓ + 2HCl SO42− + Ba2+ = BaSO4↓
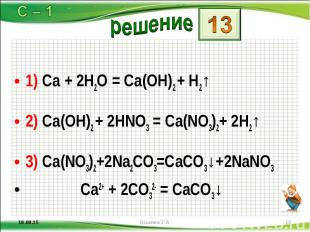
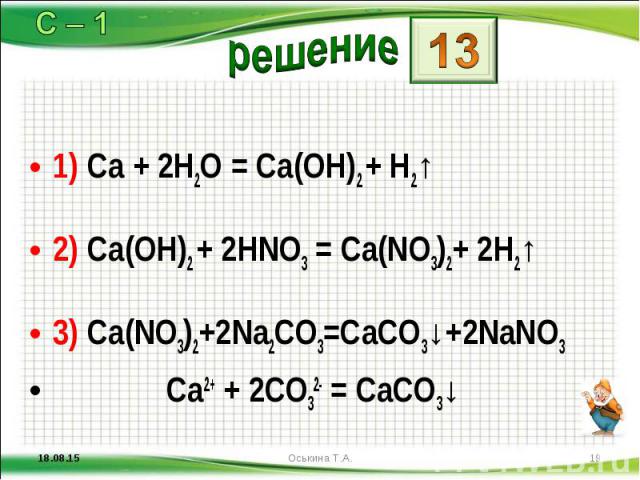
1) Ca + 2H2O = Ca(OH)2 + H2↑ 1) Ca + 2H2O = Ca(OH)2 + H2↑ 2) Ca(OH)2 + 2HNO3 = Ca(NO3)2+ 2H2↑ 3) Ca(NO3)2+2Na2CO3=CaCO3↓+2NaNO3 Ca2+ + 2CO32- = CaCO3↓
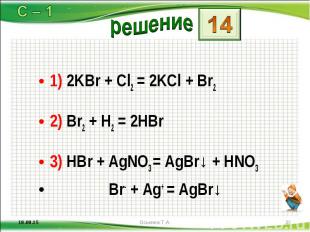
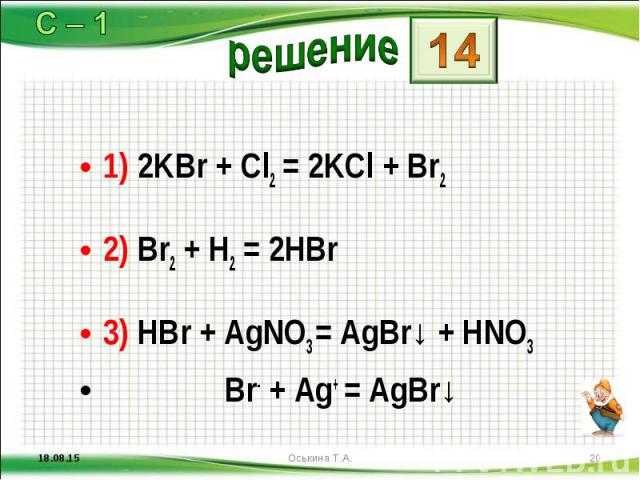
1) 2KBr + Cl2 = 2KCl + Br2 1) 2KBr + Cl2 = 2KCl + Br2 2) Br2 + H2 = 2HBr 3) HBr + AgNO3 = AgBr↓ + HNO3 Br- + Ag+ = AgBr↓

1) 2H2S + 3O2 = 2SO2↑ +2H2O 1) 2H2S + 3O2 = 2SO2↑ +2H2O 2) 2SO2 + O2 ↔ 2SO3↑ 3) SO3 + 2KOH = K2SO4 + H2O SO3 + 2OH- = SO42- + H2O

1) CuSO4 + Fe = Cu↓ + FeSO4 1) CuSO4 + Fe = Cu↓ + FeSO4 (вместо железа можно использовать другой металл средней активности) 2) 2Cu + O2 = 2CuO 3) CuO + 2HNO3 = Cu(NO3)2 + H2O CuO + 2H+ = Cu2+ + H2O
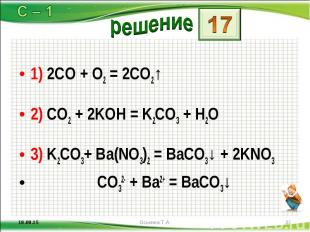
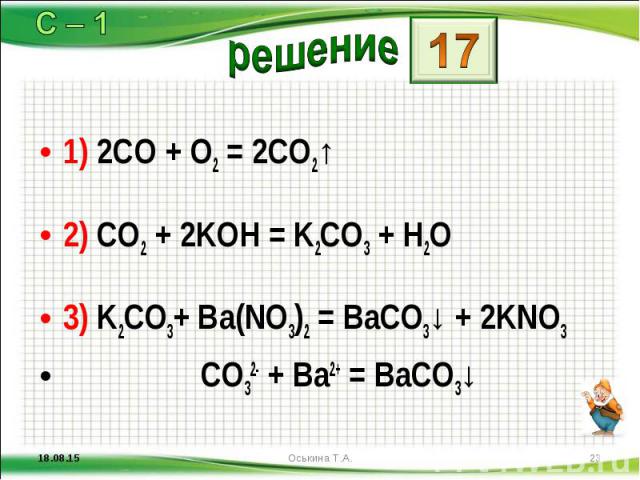
1) 2CO + O2 = 2CO2↑ 1) 2CO + O2 = 2CO2↑ 2) CO2 + 2KOH = K2CO3 + H2O 3) K2CO3+ Ba(NO3)2 = BaCO3↓ + 2KNO3 CO32- + Ba2+ = BaCO3↓
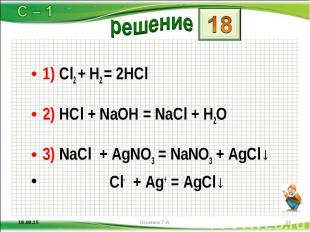
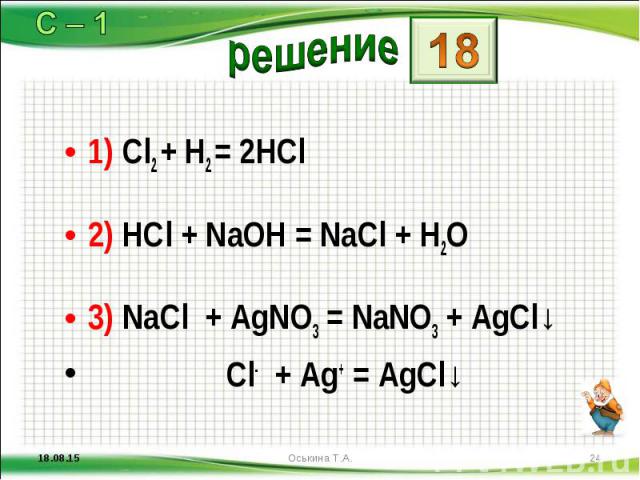
1) Cl2 + H2 = 2HCl 1) Cl2 + H2 = 2HCl 2) HCl + NaOH = NaCl + H2O 3) NaCl + AgNO3 = NaNO3 + AgCl↓ Cl- + Ag+ = AgCl↓
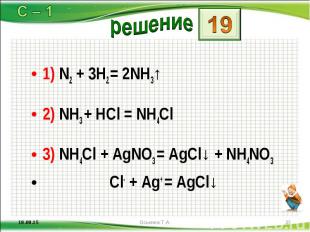
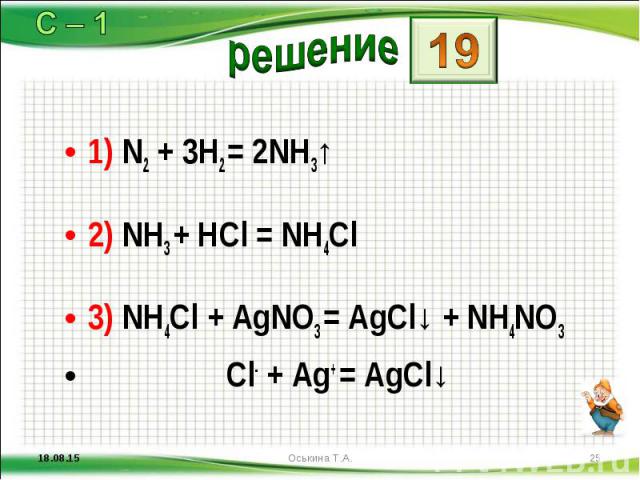
1) N2 + 3H2 = 2NH3↑ 1) N2 + 3H2 = 2NH3↑ 2) NH3 + HCl = NH4Cl 3) NH4Cl + AgNO3 = AgCl↓ + NH4NO3 Cl- + Ag+ = AgCl↓
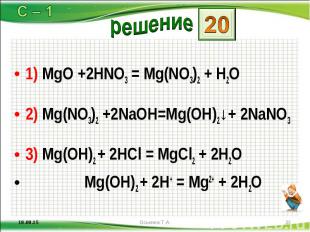
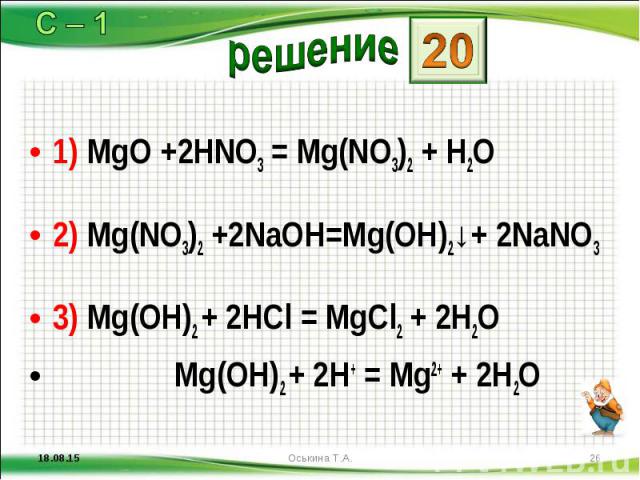
1) MgO +2HNO3 = Mg(NO3)2 + H2O 1) MgO +2HNO3 = Mg(NO3)2 + H2O 2) Mg(NO3)2 +2NaOH=Mg(OH)2↓+ 2NaNO3 3) Mg(OH)2 + 2HCl = MgCl2 + 2H2O Mg(OH)2 + 2H+ = Mg2+ + 2H2O

Демонстрационные варианты ГИА 2010-2013 гг. Демонстрационные варианты ГИА 2010-2013 гг. Тренировочные варианты экзаменационных работ для проведения государственной итоговой аттестации в новой форме/авт.-сост.Д.Ю.Добротин, А.А.Каверина. – М.: АСТ: Астрель, 2011. ГИА 2011.Химия. 9 класс. Государственная итоговая аттестация (в новой форме). Типовые тестовые задания/ А.С.Корощенко, Ю.Н.Медведев. – М.: Издательство «Экзамен», 2011.