Презентация на тему: Дефекты

Лекция 1 Курс: Химия дефектов. структура и свойства твердых тел. 900igr.net
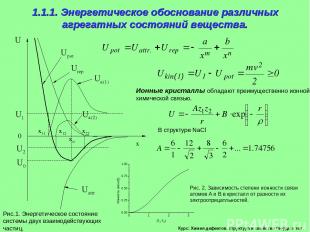
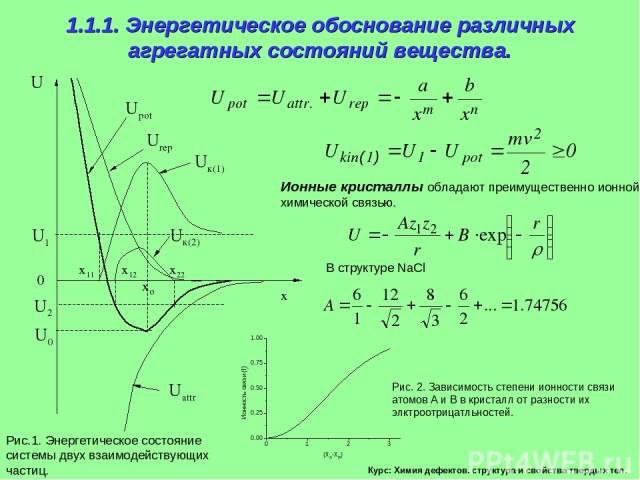
Курс: Химия дефектов. структура и свойства твердых тел. 1.1.1. Энергетическое обоснование различных агрегатных состояний вещества. Ионные кристаллы обладают преимущественно ионной химической связью. Рис.1. Энергетическое состояние системы двух взаимодействующих частиц.
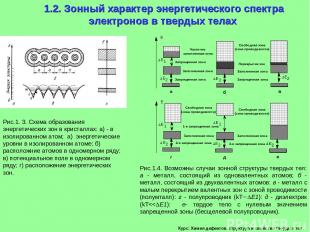
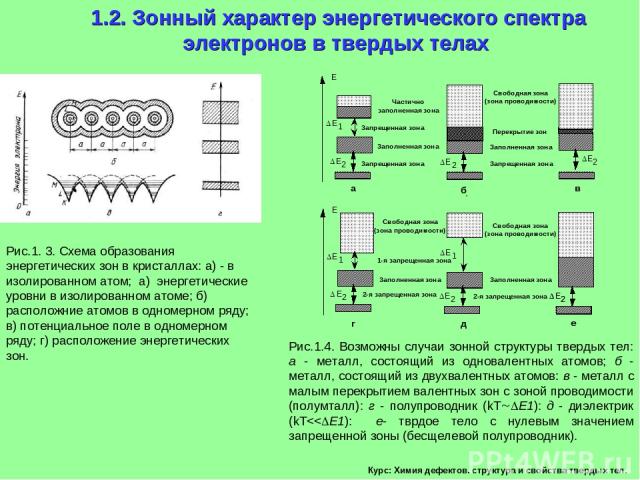
Курс: Химия дефектов. структура и свойства твердых тел. 1.2. Зонный характер энергетического спектра электронов в твердых телах Рис.1. 3. Схема образования энергетических зон в кристаллах: а) - в изолированном атом; а) энергетические уровни в изолированном атоме; б) расположние атомов в одномерном ряду; в) потенциальное поле в одномерном ряду; г) расположение энергетических зон. Рис.1.4. Возможны случаи зонной структуры твердых тел: а - металл, состоящий из одновалентных атомов; б - металл, состоящий из двухвалентных атомов: в - металл с малым перекрытием валентных зон с зоной проводимости (полумталл): г - полупроводник (kT E1): д - диэлектрик (kT

Лекция 2 Курс: Химия дефектов. структура и свойства твердых тел.
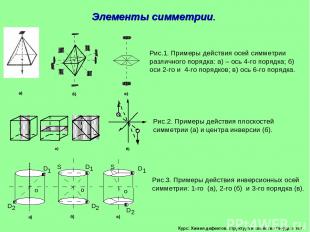
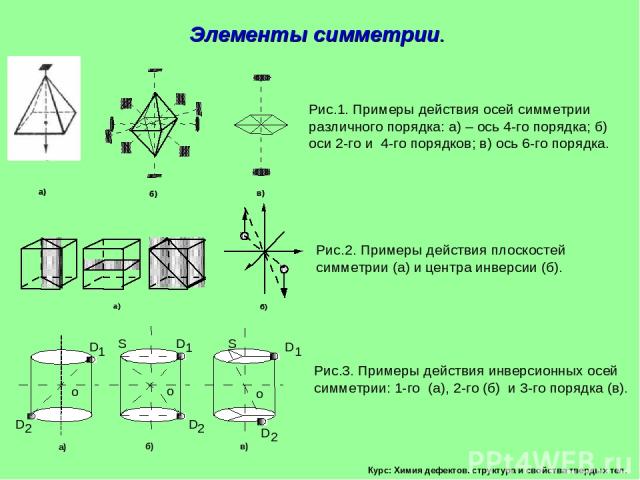
Курс: Химия дефектов. структура и свойства твердых тел. Элементы симметрии.
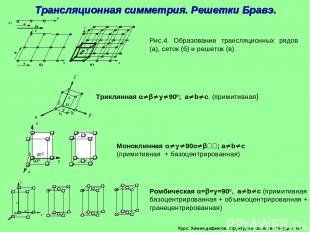
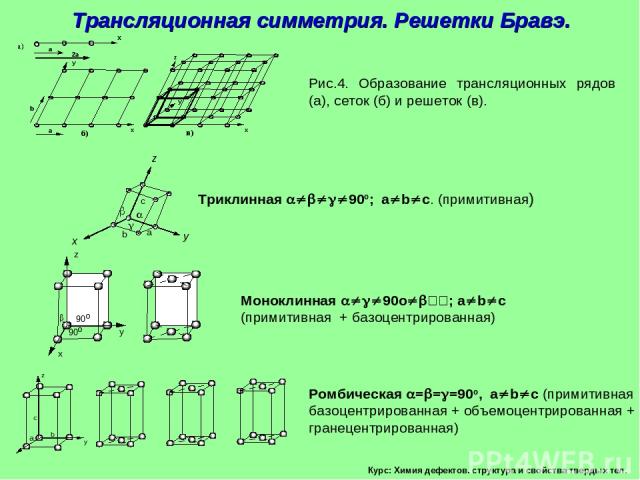
Курс: Химия дефектов. структура и свойства твердых тел. Трансляционная симметрия. Решетки Бравэ.
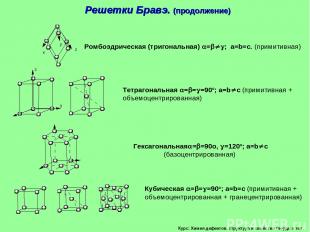
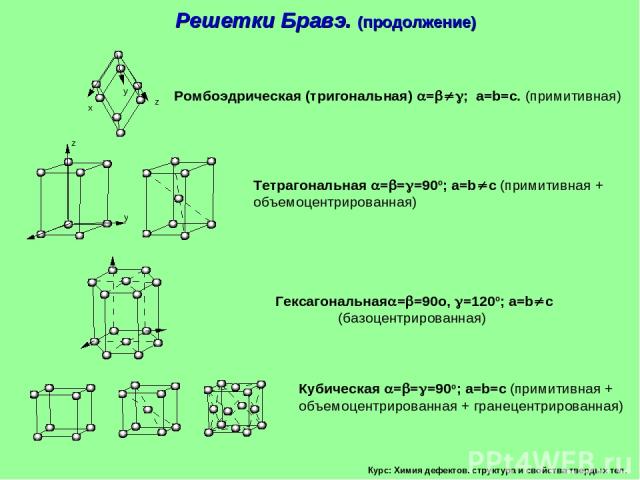
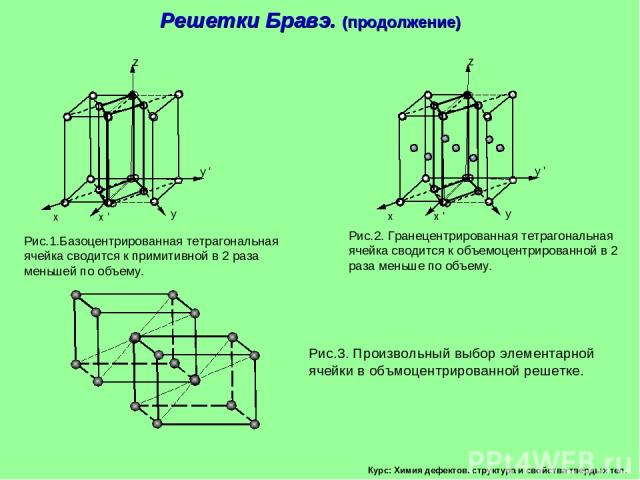
Курс: Химия дефектов. структура и свойства твердых тел. Решетки Бравэ. (продолжение)
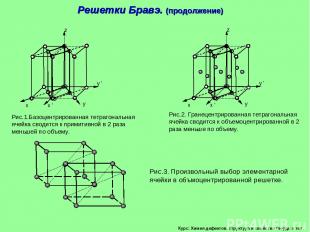
Курс: Химия дефектов. структура и свойства твердых тел. Рис.1.Базоцентрированная тетрагональная ячейка сводится к примитивной в 2 раза меньшей по объему. Рис.2. Гранецентрированная тетрагональная ячейка сводится к объемоцентрированной в 2 раза меньше по объему. Рис.3. Произвольный выбор элементарной ячейки в объмоцентрированной решетке. Решетки Бравэ. (продолжение)

Курс: Химия дефектов. структура и свойства твердых тел. Лекция 3
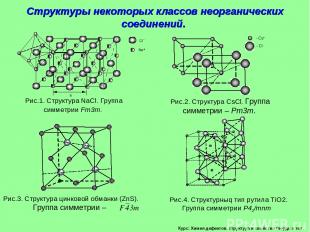
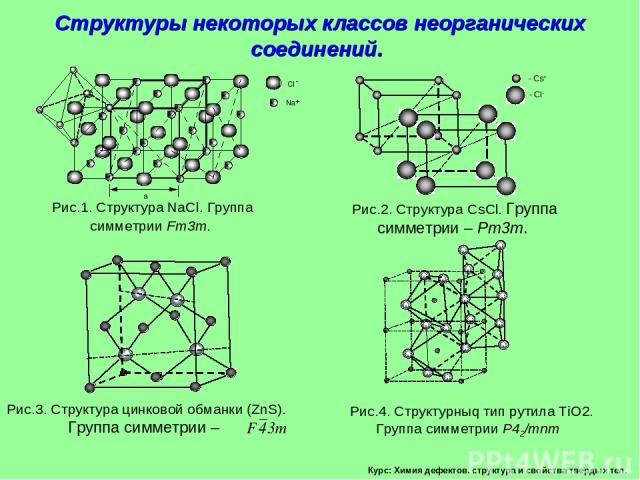
Курс: Химия дефектов. структура и свойства твердых тел. Структуры некоторых классов неорганических соединений.
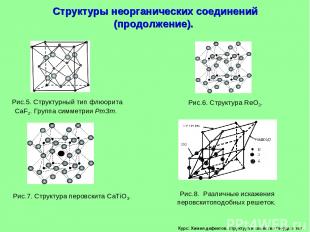
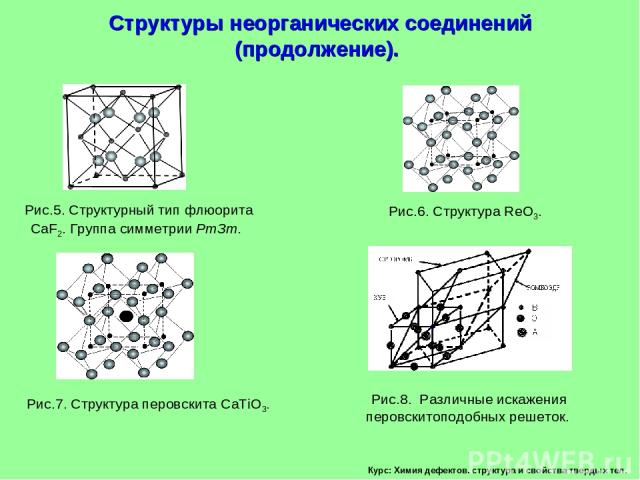
Курс: Химия дефектов. структура и свойства твердых тел. Структуры неорганических соединений (продолжение).
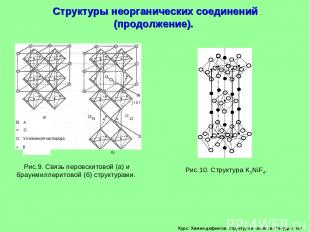
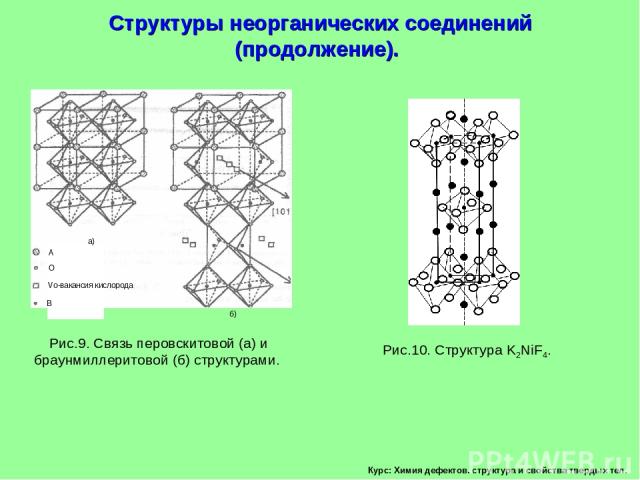
Курс: Химия дефектов. структура и свойства твердых тел. Структуры неорганических соединений (продолжение).

Курс: Химия дефектов. структура и свойства твердых тел. Лекция 4
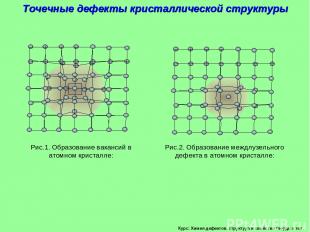
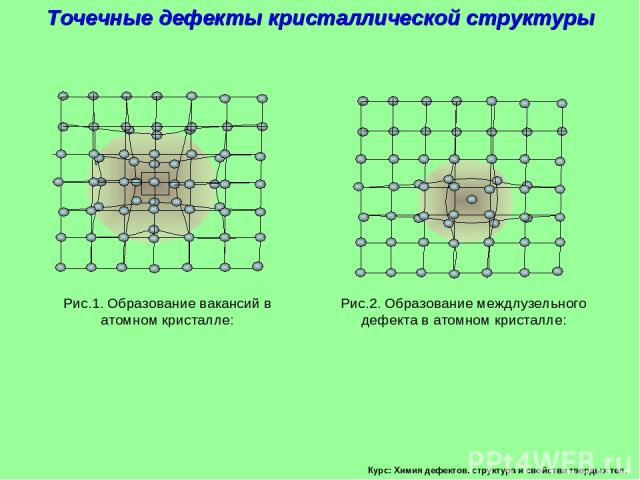
Курс: Химия дефектов. структура и свойства твердых тел. Точечные дефекты кристаллической структуры Рис.1. Образование вакансий в атомном кристалле: Рис.2. Образование междлузельного дефекта в атомном кристалле:
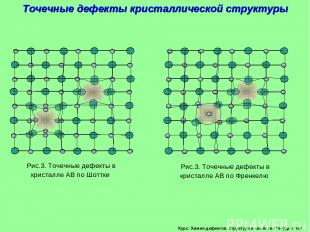
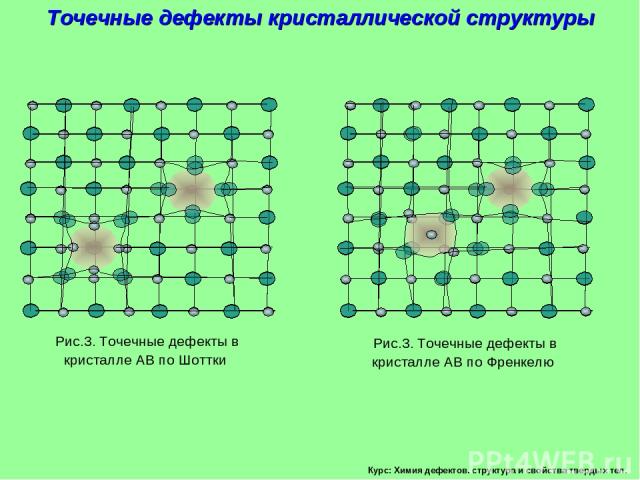
Курс: Химия дефектов. структура и свойства твердых тел. Точечные дефекты кристаллической структуры Рис.3. Точечные дефекты в кристалле АВ по Шоттки Рис.3. Точечные дефекты в кристалле АВ по Френкелю
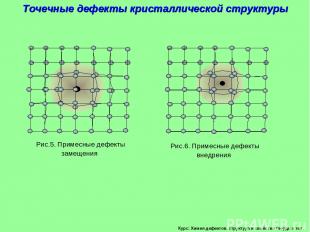
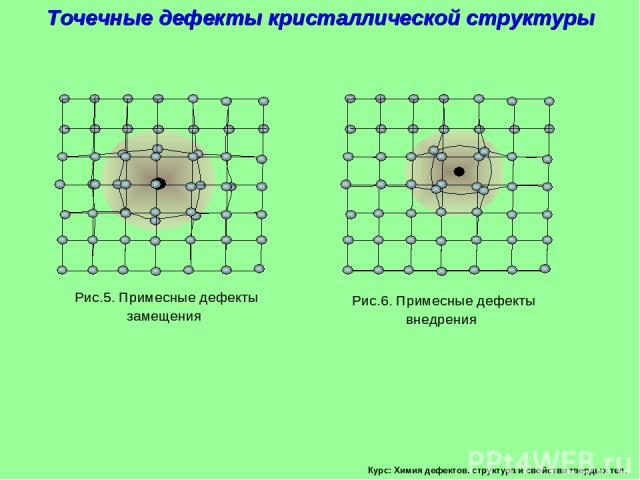
Курс: Химия дефектов. структура и свойства твердых тел. Рис.5. Примесные дефекты замещения Рис.6. Примесные дефекты внедрения Точечные дефекты кристаллической структуры
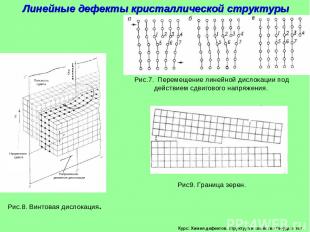
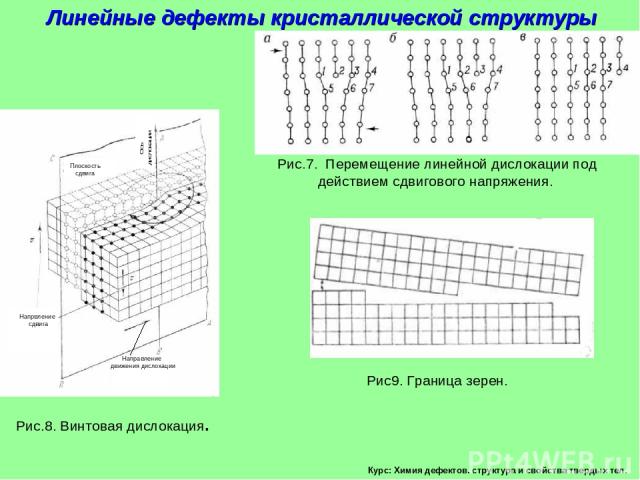
Курс: Химия дефектов. структура и свойства твердых тел. Линейные дефекты кристаллической структуры

Лекция 5 Курс: Химия дефектов. структура и свойства твердых тел.

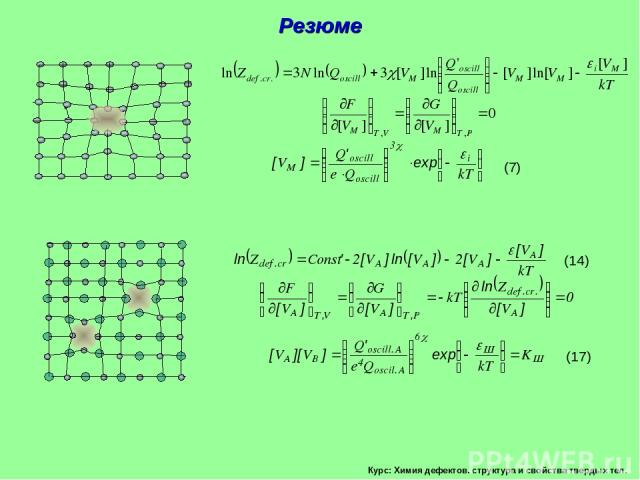
Курс: Химия дефектов. структура и свойства твердых тел. Сумма по состояниям дефектного кристалла. Металлический кристалл М разупорядоченный по вакансионному типу ([MM]>>[VM]). Общее число позиций, по которым возможно распределение [VM] дефектов в таком кристалле обозначим N = [MM]+[VM]. Энергия, пошедшая на образования всех дефектов в кристалле i[VM]= Еv. Учтем, что [MM]>>[VM] и N [MM], тогда получим

Курс: Химия дефектов. структура и свойства твердых тел. Термическое равновесие дефектного кристалла простого вещества М. Условием термодинамического равновесия такого дефектного кристалла при T,V=Const является минимизация F , при T,Р=Const –G . Выражение (4) при T=Const имеет такой же вид, как и уравнение изохоры (изобары) химической реакции null=VM. Структурные элементы кристалла рассматриваются как независимые компонент

Курс: Химия дефектов. структура и свойства твердых тел. Термическое равновесие дефектного кристалла бинарного соединения АВ. Разупорядоченность по Шоттки. [АА] - число занятых узлов в подрешетке металла; [BB] - число занятых узлов в подрешетке металлоида; [VА] - число вакансий в подрешетке металла; [VB] — число вакансий в подрешетке металлоида. NA - число узлов (занятых и свободных) в металлической подрешетке; NB - число узлов (занятых и свободных) в неметаллической подрешетке кристалла АВ.

Курс: Химия дефектов. структура и свойства твердых тел. Разупорядоченность по Шоттки (продолжение). Учтем, что при температурах далеких от плавления соединения АВ, AA >> VA , NA=AA и lnN!=NlnN–N , тогда [VA]=[VB], тогда окончательно выражение для термически равновесных концентраций дефектов Шоттки запишется Полученное выражение определяет закон действия масс для реакции образования дефектов по Шоттки null=VA+VB
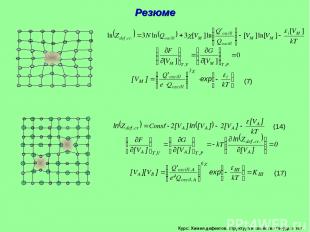
Курс: Химия дефектов. структура и свойства твердых тел. Резюме

Курс: Химия дефектов. структура и свойства твердых тел. Лекция 6

Курс: Химия дефектов. структура и свойства твердых тел. Правила записи процессов образования и ионизации точечных дефектов. Реакция образования дефектов по Шоттки в кристаллическом веществе типа АВ2 Уравнения реакций с участием точечных дефектов должны удовлетворять трем требованиям: а) закону сохранения массы, б) закону сохранения заряда, в) постоянству соотношения позиций разных атомов в кристалле. Реакция образования дефектов по Френкелю в кристаллическом веществе типа АВ2 Ионизация дефектов Образование нейтральных дефектов

Курс: Химия дефектов. структура и свойства твердых тел. Рассматриваемый подход к ионизации нейтральных атомных дефектов применим и для кристаллов с сильно выраженной ионной или ковалентной химическими связями Правила записи процессов образования и ионизации точечных дефектов (продолжение). Образование нейтральных дефектов по Шоттки в NaCl Или окончательно процесс образования дефектов в NaCl можно записать

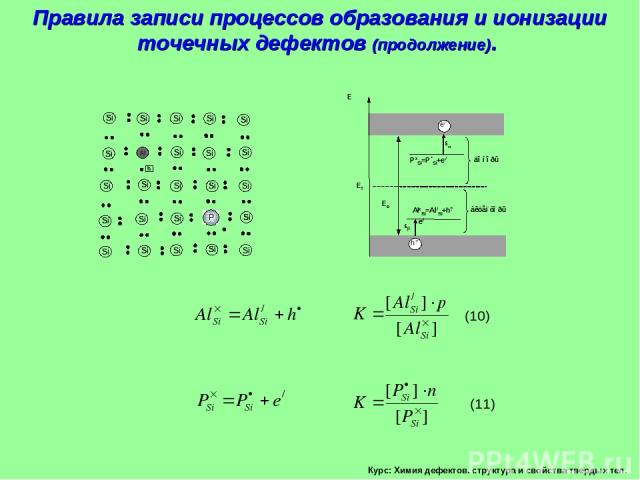
Курс: Химия дефектов. структура и свойства твердых тел. Правила записи процессов образования и ионизации точечных дефектов (продолжение).

Лекция 7 Курс: Химия дефектов. структура и свойства твердых тел.

Курс: Химия дефектов. структура и свойства твердых тел. Электронно-дырочное равновесие дефектов Состояние электрона с энергией можно характеризовать значением его импульса Подсчитаем число ячеек g( ) по которым распределяются электроны (невырожденное состояние) в интервале энергий от до +d объемом h3=dxdydzdpxdpydpz Определим число электронных состояний в промежутке между и d . Наглядным образом может служить изо энергетическая поверхность, отвечающая всем значениям ε в пространстве импульсов ρ+dρ Общее число электронов в зоне проводимости определяется из соотношения Здесь f(x) вероятность нахождения электрона на данном уровне. Для простоты возьмем 0=0 – нуль отсчета энергии совпадает с дном зоны проводимости. Верхний предел энергии можно продлить до бесконечности, так как с ростом энергии функция f(x) очень быстро убывает

Курс: Химия дефектов. структура и свойства твердых тел. Электронно-дырочное равновесие дефектов (продолжение). Далее вынесем из под интеграла все величины, не зависящие от энергии, и превратим подынтегральное выражение в безразмерное. Для этого умножим и разделим его на (kT)3/2 , , Аналогичные вычисления дают число дырок в заполненной (валентной) зоне Концентрации электронов и дырок взаимосвязаны. Действительно, умножением уравнений (1) и (2) получаем Подставляем (2), (4) в (3) и получаем

Курс: Химия дефектов. структура и свойства твердых тел. Электронно-дырочное равновесие дефектов (продолжение). Полученное выражение (8) по своей сути представляет закон действия масс реакции образования электронных дефектов в твердом теле null=e/+h•.

Лекция 8 Курс: Химия дефектов. структура и свойства твердых тел.

Курс: Химия дефектов. структура и свойства твердых тел. Полное термическое равновесие собственных дефектов в полупроводниках (Ge, Si). Собственное электронное разупорядочение Образование вакансий кремния (дефектов Шоттки)

Курс: Химия дефектов. структура и свойства твердых тел. Полное термическое равновесие собственных дефектов в полупроводниках (Ge, Si) (продолжение). Метод аппроксимации условия электронейтральности (м.Броуэра)
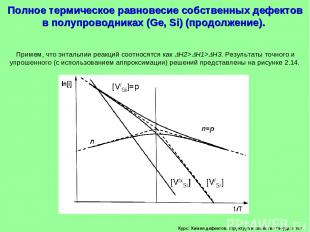
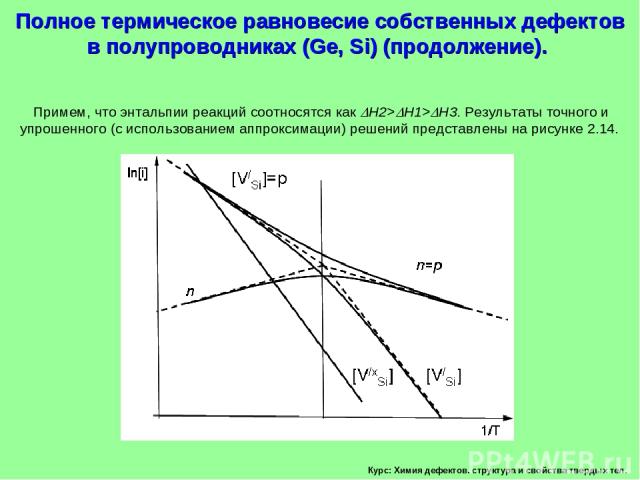
Курс: Химия дефектов. структура и свойства твердых тел. Примем, что энтальпии реакций соотносятся как H2> H1> H3. Результаты точного и упрошенного (с использованием аппроксимации) решений представлены на рисунке 2.14. Полное термическое равновесие собственных дефектов в полупроводниках (Ge, Si) (продолжение).

Курс: Химия дефектов. структура и свойства твердых тел. Лекция 9

Курс: Химия дефектов. структура и свойства твердых тел. Влияние газовой фазы на равновесия дефектов твердых тел. АВ1 (тв)=В2(газ) Проанализируем влияние давления компонента в газовой фазе на процессы дефектообразования в кристалле на примере оксида МО1 , находящегося при Т=Const в равновесии с газовой фазой, содержащей кислород.

Курс: Химия дефектов. структура и свойства твердых тел. Влияние газовой фазы на равновесия дефектов твердых тел (продолжение). II. Средняя область рО2
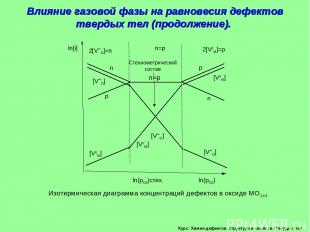
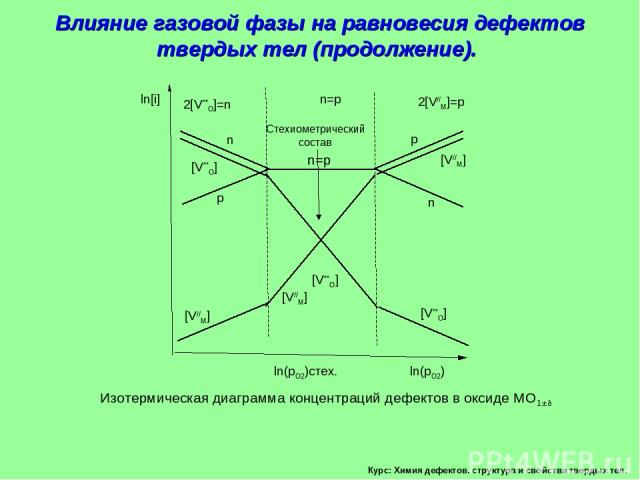
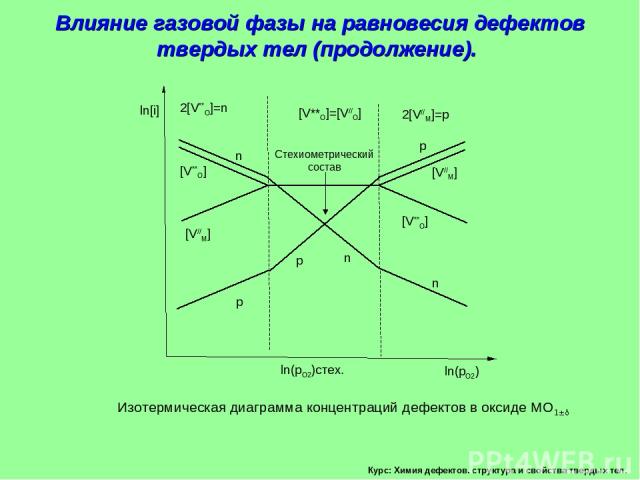
Курс: Химия дефектов. структура и свойства твердых тел. Влияние газовой фазы на равновесия дефектов твердых тел (продолжение). Изотермическая диаграмма концентраций дефектов в оксиде МО1
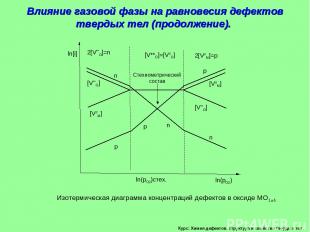
Курс: Химия дефектов. структура и свойства твердых тел. Влияние газовой фазы на равновесия дефектов твердых тел (продолжение). Изотермическая диаграмма концентраций дефектов в оксиде МО1

Лекция 10 Курс: Химия дефектов. структура и свойства твердых тел.
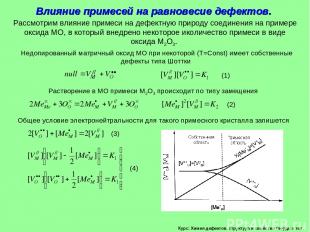
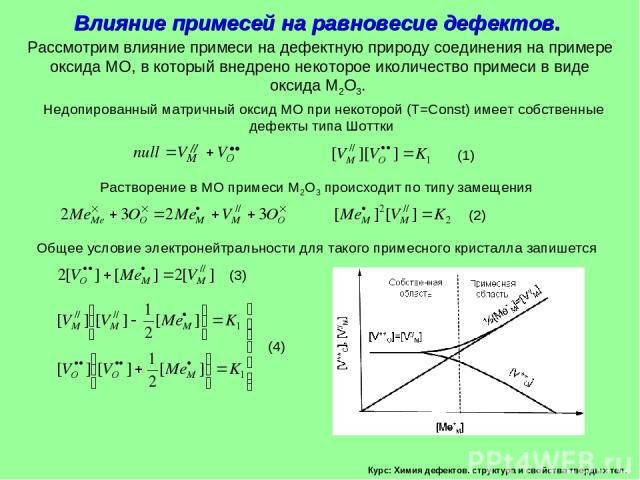
Курс: Химия дефектов. структура и свойства твердых тел. Влияние примесей на равновесие дефектов. Рассмотрим влияние примеси на дефектную природу соединения на примере оксида МО, в который внедрено некоторое иколичество примеси в виде оксида М2О3. Недопированный матричный оксид МО при некоторой (Т=Const) имеет собственные дефекты типа Шоттки Растворение в МО примеси М2О3 происходит по типу замещения Общее условие электронейтральности для такого примесного кристалла запишется
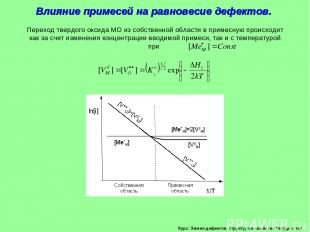
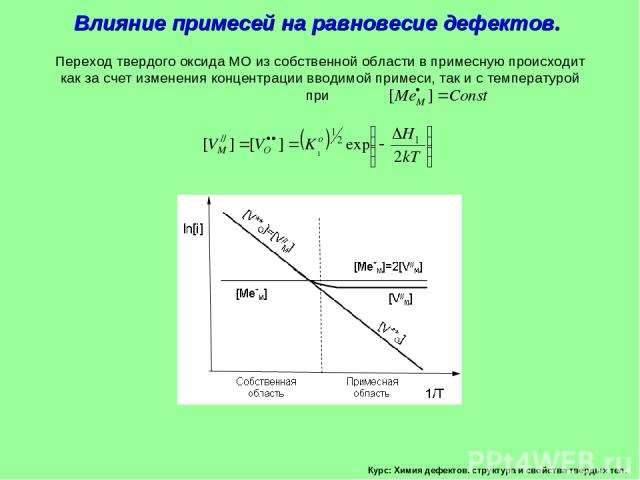
Курс: Химия дефектов. структура и свойства твердых тел. Влияние примесей на равновесие дефектов.

Лекция 11 Курс: Химия дефектов. структура и свойства твердых тел.

Курс: Химия дефектов. структура и свойства твердых тел. III. ЯВЛЕНИЯ ПЕРЕНОСА В ТВЕРДЫХ ТЕЛАХ. 3.1. Элементы неравновесной термодинамики 3.1.1. Возникновение энтропии в неравновесных системах.

Курс: Химия дефектов. структура и свойства твердых тел. 3.1.1. Возникновение энтропии в неравновесных системах (продолжение). Рассмотрим, например, тенденцию к минимизации энергии Гиббса в самопроизвольных химических процессах В системе протекает k реакций; каждая реакция характеризуется скоростью vk химическим сродством Ak Производство энтропии неравновесной системы, в которой наряду с химическими реакциями имеются градиенты температуры, химических потенциалов частиц и электрического поля, запишется в виде Химические реакции Поток - скорость реакции vj Диффузия Поток - массы Jm Электропроводность Электрический ток Je Теплопроводность Поток энергии Ju

Курс: Химия дефектов. структура и свойства твердых тел. 3.1.2. Принципы линейности и взаимности потоков. Принцип линейности. Сущность данного принципа состоит в утверждении, что не очень далеко от состояния термодинамического равновесия скорость необратимого процесса (поток) пропорциональна действующей силе. (Онзагер 1931 г.) И так, производство энтропии на единицу объема может быть записано в виде Скорость любого процесса (теплопроводности, диффузии, электропроводности и др.) определяется как плотность потока (Ji) вещества, энергии, количества электричества и др., протекающего за единицу времени через единицу поверхности, перпендикулярной потоку. Принцип взаимности. Возникающие в неравновесной системе потоки влияют друг на друга. Другими словами потоки взаимны. . (Онзагер 1931 г.)

Курс: Химия дефектов. структура и свойства твердых тел. 3.1.2. Принципы линейности и взаимности потоков (продолжение). Принцип взаимности потоков согласно Онзагеру выражается аналитической системой уравнений Опыт показывает, что, при наложении какого-нибудь градиента на систему одновременно возникают потоки тепла, массы и электричества Т.н. «перекрестные» явления широко используются в технике

Курс: Химия дефектов. структура и свойства твердых тел. В условиях, когда справедливы линейные феноменологические соотношения (10, 11), производство энтропии (9) принимает квадратичную форму: Кинетические коэффициенты обладают свойством взаимности 3.1.2. Принципы линейности и взаимности потоков (продолжение). Входящие в выражение (15) потоки, в соответствии с принципами линейности и взаимности, и ур. (14) будут

Курс: Химия дефектов. структура и свойства твердых тел. Лекция 12

Курс: Химия дефектов. структура и свойства твердых тел. 3.2. Феноменологические соотношения для потоков массы, заряда и тепла 3.2.1. Перенос нейтральных частиц в химическом поле. Простейший случай - перенос нейтральной частицы А происходит за счет действия градиента химического потенциала. Для одномерной задачи имеем Кинетический коэффициент переноса нейтральной частицы А в градиенте химического потенциала можно выразить через линейную скорость vA и абсолютную подвижность uA.

Курс: Химия дефектов. структура и свойства твердых тел. 3.2.1. Перенос нейтральных частиц в химическом поле (продолжение). Согласно теории случайных перескоков частицы в направлении х поток определяется n - число перескоков за время t, s – длина одинарного перескока - частота перескоков Курс: Химия дефектов. структура и свойства твердых тел.

Курс: Химия дефектов. структура и свойства твердых тел. 3.2.2. Перенос заряда в электрическом поле. Электропроводность. Заряженные частицы движутся под действием внешнего электрического поля, но их перемещение не связано с переносом массы (например перенос электронных дефектов). С учетом ур.(10) получаем еще один вид уравнения Нернста-Эйнштейна

Курс: Химия дефектов. структура и свойства твердых тел. Курс: Химия дефектов. структура и свойства твердых тел. 3.2.3. Совместный перенос тепла и заряда. Термоэлектрические явления. Производство энтропии в единице объема Для одномерной системы Закон Ома je= Е

Лекция 13 Курс: Химия дефектов. структура и свойства твердых тел.

Курс: Химия дефектов. структура и свойства твердых тел. 1. Подвижная частица несет массу и заряд 3.2.4. Совместный перенос массы и заряда. Электрохимический перенос. 2. Частицы каждого данного сорта (катионы, анионы, электроны) движутся независимо от частиц других сортов. Потоки массы (J1) и зарядов (J2) взаимны Ранее были получены соотношения: Отсюда уравнение для потока можно выразить в различных физических величинах (коэффициента диффузии, удельной электропроводности и подвижности) Здесь i= i+zie - электрохимический потенциал
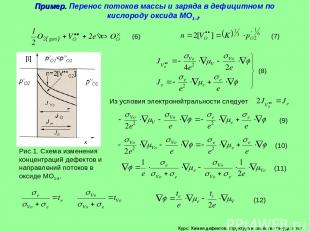
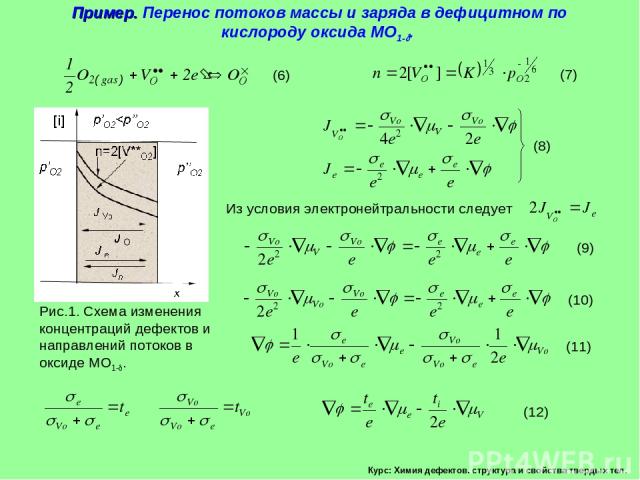
Курс: Химия дефектов. структура и свойства твердых тел. Пример. Перенос потоков массы и заряда в дефицитном по кислороду оксида МО1- .

Курс: Химия дефектов. структура и свойства твердых тел. Пример. Перенос потоков массы и заряда в дефицитном по кислороду оксида МО1- . (продолжение) Возьмём производные по толщине фазы оксида Поток вакансий кислорода, согласно условию электронейтральности кристалла, равен

Курс: Химия дефектов. структура и свойства твердых тел. Поток кислорода в пересчете на 1 моль можно записать в виде Пример. Перенос потоков массы и заряда в дефицитном по кислороду оксида МО1- . (продолжение)

Лекция 14 Курс: Химия дефектов. структура и свойства твердых тел.
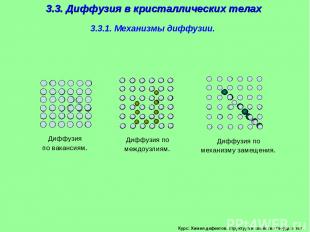
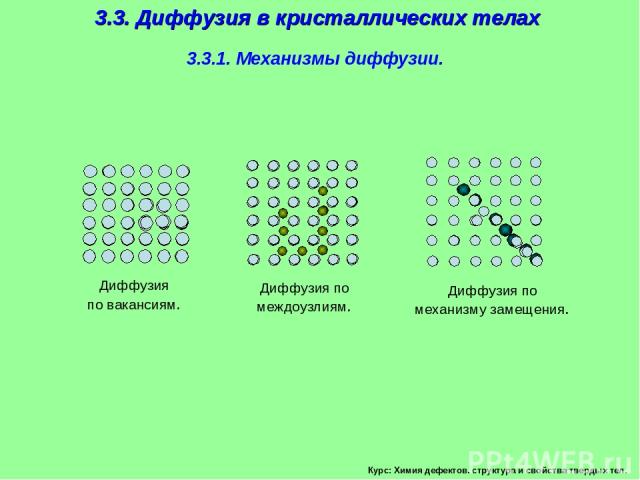
3.3. Диффузия в кристаллических телах 3.3.1. Механизмы диффузии. Диффузия по вакансиям. Диффузия по междоузлиям. Диффузия по механизму замещения. Курс: Химия дефектов. структура и свойства твердых тел.

Курс: Химия дефектов. структура и свойства твердых тел. 3.3.2. Хаотическая диффузия. Коэффициент хаотической диффузии. Суммарное радиальное смещение диффундирующего атома после п. перемещений (Rn) определится суммой отдельных перескоков s1, s2,…si Вакансионный механизм переноса Число перескоков вакансий определяется выражением В общем случае коэффициент хаотической диффузии по вакансионному механизму будет равен Междоузельный механизм переноса.

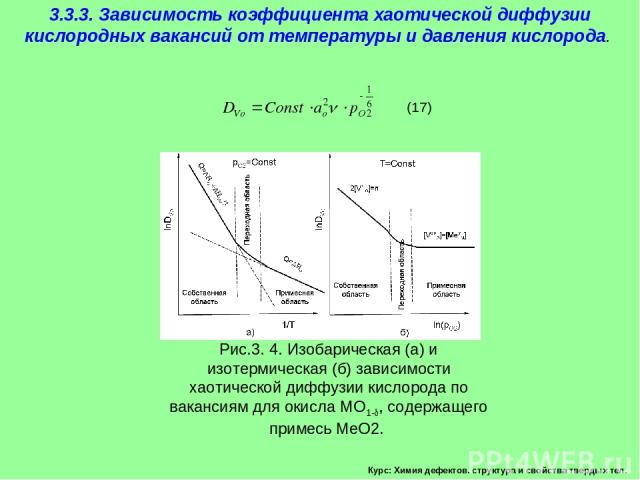
Курс: Химия дефектов. структура и свойства твердых тел. 3.3.3. Зависимость коэффициента хаотической диффузии кислородных вакансий от температуры и давления кислорода. Рассмотрим влияние температуры на коэффициент хаотической диффузии на примере переноса кислорода по вакансионному механизму в оксиде МО1- (13)
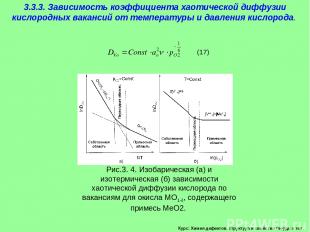
Курс: Химия дефектов. структура и свойства твердых тел. 3.3.3. Зависимость коэффициента хаотической диффузии кислородных вакансий от температуры и давления кислорода.

Лекция 15 Курс: Химия дефектов. структура и свойства твердых тел.

Курс: Химия дефектов. структура и свойства твердых тел. 3.3.4. Химический коэффициент диффузии. ci – концентрация, vi - линейная скорость перемещения i-той частицы, Пример 1. Растворение примесного атома F донорного типа в твердой фазе А. Рис.1. Схема направления потоков и изменение концентраций примесного дефекта и электронов в фазе А.

Курс: Химия дефектов. структура и свойства твердых тел. Лекция 16

3.3.4. Перенос вещества в химическом поле. Химический коэффициент диффузии. Химическая диффузия - процесс вещества в химическом поле, когда имеется отличный от нуля градиент химического потенциала хотя бы одного из компонентов. Пример 1. Растворение примесного атома F донорного типа в твердой фазе А. Курс: Химия дефектов. структура и свойства твердых тел. Выражение (1) является законом Фика для сопряженного переноса двух и более частиц

Из условия стационарности Jm=Je находим градиент электрического потенциала Курс: Химия дефектов. структура и свойства твердых тел. 3.3.4. Перенос вещества в химическом поле. (продолжение). С учетом (4), (5) и (6) Подставляем (7) в (3) и находим окончательно поток примесных атомов в твердую фазу А Сравним полученное выражение с ур. (1) – законом Фика
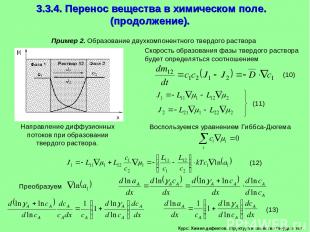
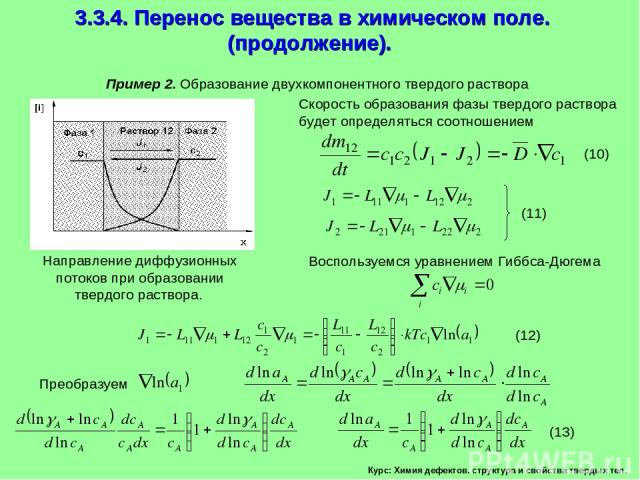
Курс: Химия дефектов. структура и свойства твердых тел. 3.3.4. Перенос вещества в химическом поле. (продолжение). Пример 2. Образование двухкомпонентного твердого раствора Скорость образования фазы твердого раствора будет определяться соотношением Воспользуемся уравнением Гиббса-Дюгема

Курс: Химия дефектов. структура и свойства твердых тел. 3.3.4. Перенос вещества в химическом поле. (продолжение). Подставляем (13) в (12) и для сопряженных потоков компонентов получаем Перекрестные кинетические коэффициенты равны L12=L21 (15)

Курс: Химия дефектов. структура и свойства твердых тел. Лекция 17

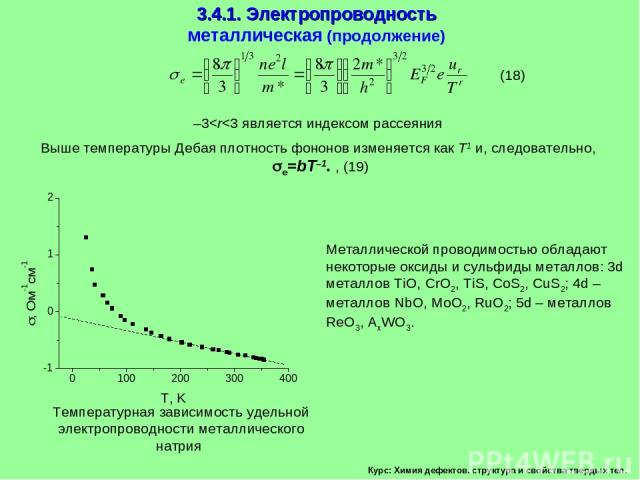
3.4. Электрические свойства твердых тел 3.4.1. Электропроводность. Курс: Химия дефектов. структура и свойства твердых тел. Плотность электрического тока Металлическая проводимость Сравниваем это выражение с законом Ома
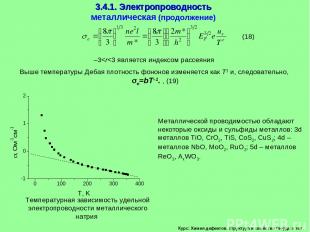
Курс: Химия дефектов. структура и свойства твердых тел. 3.4.1. Электропроводность металлическая (продолжение) Выше температуры Дебая плотность фононов изменяется как Т1 и, следовательно, e=bT–1. , (19) Металлической проводимостью обладают некоторые оксиды и сульфиды металлов: 3d металлов TiO, CrO2, TiS, CoS2, CuS2; 4d – металлов NbO, MoO2, RuO2; 5d – металлов ReO3, AxWO3. –3

Курс: Химия дефектов. структура и свойства твердых тел. 3.4.1. Электропроводность (продолжение) Полупроводники. Для собственных полупроводников Температурная зависимость электронной проводимости определяется концентрацией и подвижностью носителей. Например, в собственной области разупорядочения окисла с дефицитом кислорода MO1– и преобладанием двухзарядных кислородных вакансий
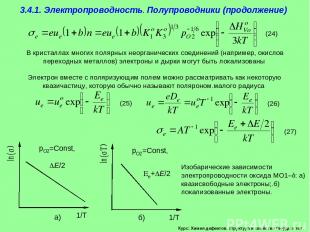
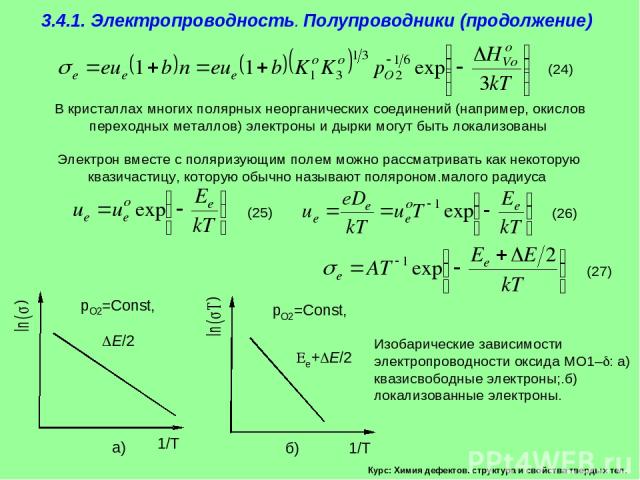
Курс: Химия дефектов. структура и свойства твердых тел. 3.4.1. Электропроводность. Полупроводники (продолжение) В кристаллах многих полярных неорганических соединений (например, окислов переходных металлов) электроны и дырки могут быть локализованы Электрон вместе с поляризующим полем можно рассматривать как некоторую квазичастицу, которую обычно называют поляроном.малого радиуса
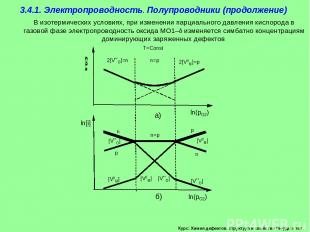
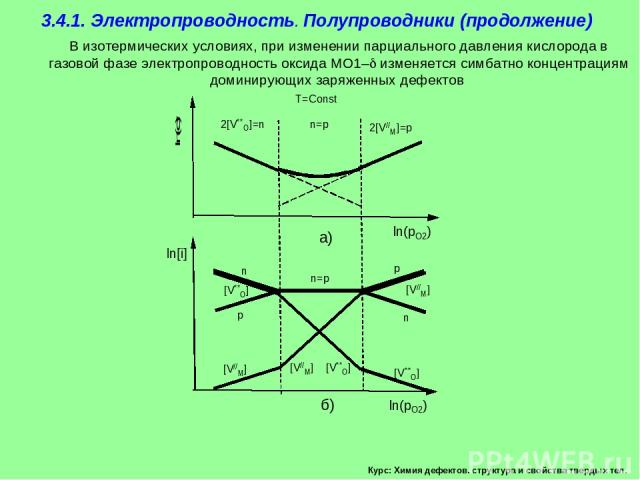
Курс: Химия дефектов. структура и свойства твердых тел. 3.4.1. Электропроводность. Полупроводники (продолжение) В изотермических условиях, при изменении парциального давления кислорода в газовой фазе электропроводность оксида MO1– изменяется симбатно концентрациям доминирующих заряженных дефектов

Курс: Химия дефектов. структура и свойства твердых тел. Лекция 18

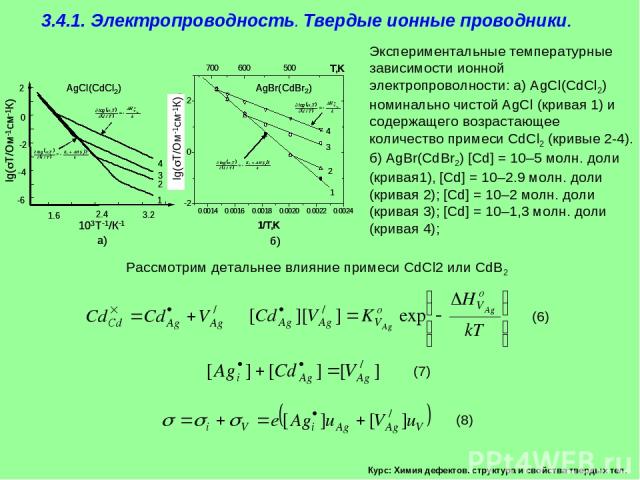
Курс: Химия дефектов. структура и свойства твердых тел. 3.4.1. Электропроводность. Твердые ионные проводники. Рассмотрим в качестве примера галогенид серебра AgCl или AgBr, в котором разупорядоченность по Френкелю приводят к ионной электропроводности

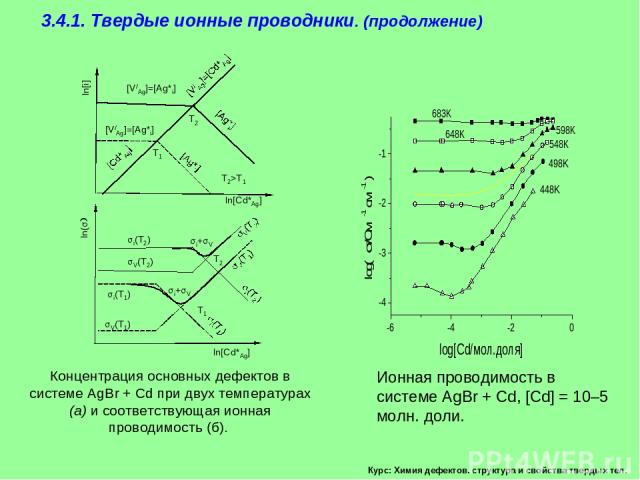
Курс: Химия дефектов. структура и свойства твердых тел. 3.4.1. Электропроводность. Твердые ионные проводники. Рассмотрим детальнее влияние примеси CdCl2 или CdB2
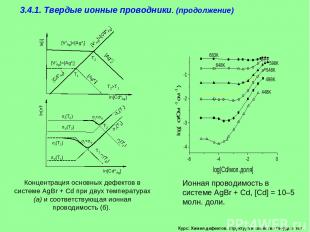
Курс: Химия дефектов. структура и свойства твердых тел. 3.4.1. Твердые ионные проводники. (продолжение)

Курс: Химия дефектов. структура и свойства твердых тел. 3.4.2. Числа переноса. Здесь = +е – градиент электрохимического потенциала. Если положить, что ток не нарушает термодинамического равновесия (п р=К.), т. е. Электронный ток

Курс: Химия дефектов. структура и свойства твердых тел. 3.4.2. Числа переноса (продолжение). Ионный ток. Считаем, что ток не нарушает термодинамического равновесия ([A+][B–]=Kion)

Курс: Химия дефектов. структура и свойства твердых тел. 3.4.2. Числа переноса (продолжение). Ионный ток. Если через ячейку ток не протекает, то выполняется очевидное соотношение

Курс: Химия дефектов. структура и свойства твердых тел. Лекция 19

Курс: Химия дефектов. структура и свойства твердых тел. 3.4.3. Термо-ЭДС. Эффект Зеебека. (5)

Курс: Химия дефектов. структура и свойства твердых тел. 3.4.3. Термо-ЭДС. Эффект Зеебека (продолжение). Ионные кристаллы – твердые электролиты.

Курс: Химия дефектов. структура и свойства твердых тел. 3.4.3. Термо-ЭДС. Эффект Зеебека (продолжение). (9) Равновесие будет нарушаться, если контактная разница потенциалов не равна нулю

Курс: Химия дефектов. структура и свойства твердых тел. 3.4.3. Термо-ЭДС. Эффект Зеебека (продолжение). Модель локализованных электронных дефектов






![Курс: Химия дефектов. структура и свойства твердых тел. Сумма по состояниям дефектного кристалла. Металлический кристалл М разупорядоченный по вакансионному типу ([MM]>>[VM]). Общее число позиций, по которым возможно распределение [VM] дефектов в та… Курс: Химия дефектов. структура и свойства твердых тел. Сумма по состояниям дефектного кристалла. Металлический кристалл М разупорядоченный по вакансионному типу ([MM]>>[VM]). Общее число позиций, по которым возможно распределение [VM] дефектов в та…](https://fs3.ppt4web.ru/images/132073/183475/640/img18.jpg)

![Курс: Химия дефектов. структура и свойства твердых тел. Термическое равновесие дефектного кристалла бинарного соединения АВ. Разупорядоченность по Шоттки. [АА] - число занятых узлов в подрешетке металла; [BB] - число занятых узлов в подрешетке метал… Курс: Химия дефектов. структура и свойства твердых тел. Термическое равновесие дефектного кристалла бинарного соединения АВ. Разупорядоченность по Шоттки. [АА] - число занятых узлов в подрешетке металла; [BB] - число занятых узлов в подрешетке метал…](https://fs3.ppt4web.ru/images/132073/183475/640/img20.jpg)
![Курс: Химия дефектов. структура и свойства твердых тел. Разупорядоченность по Шоттки (продолжение). Учтем, что при температурах далеких от плавления соединения АВ, AA >> VA , NA=AA и lnN!=NlnN–N , тогда [VA]=[VB], тогда окончательно выражение для те… Курс: Химия дефектов. структура и свойства твердых тел. Разупорядоченность по Шоттки (продолжение). Учтем, что при температурах далеких от плавления соединения АВ, AA >> VA , NA=AA и lnN!=NlnN–N , тогда [VA]=[VB], тогда окончательно выражение для те…](https://fs3.ppt4web.ru/images/132073/183475/640/img21.jpg)












































![Курс: Химия дефектов. структура и свойства твердых тел. 3.4.2. Числа переноса (продолжение). Ионный ток. Считаем, что ток не нарушает термодинамического равновесия ([A+][B–]=Kion) Курс: Химия дефектов. структура и свойства твердых тел. 3.4.2. Числа переноса (продолжение). Ионный ток. Считаем, что ток не нарушает термодинамического равновесия ([A+][B–]=Kion)](https://fs3.ppt4web.ru/images/132073/183475/640/img82.jpg)

















