Презентация на тему: Теория атома водорода по Бору

Глава 27. Теория атома водорода по Бору Большую роль в развитии атомистической теории сыграл Д. И. Менделеев, разработавший в 1869 г. Периодическую систему элементов, в которой впервые на научной основе был поставлен вопрос о единой природе атомов. Во второй половине XIX в. экспериментально было доказано, что электрон является одной из основных составных частей любого вещества. Эти выводы, а также многочисленные экспериментальные данные привели к тому, что в начале XX в. серьезно встал вопрос о строении атома.

Модель атома Дж. Дж. Томсона (1903) Согласно этой модели, атом представляет собой непрерывно заряженный положительным зарядом шар радиусом порядка 10-10м, внутри которого около своих положений равновесия колеблются электроны. Суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален.

Ядерная (планетарная) модель атома Резерфорда (1911) Согласно этой модели, вокруг положительного ядра, имеющего заряд Ze (Z — порядковый номер элемента в системе Менделеева, е — элементарный заряд), размер 10-15 — 10-14 м и массу, практически равную массе атома,в области с линейными размерами порядка 10-10 м по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра должно вращаться Z электронов.

Второй закон Ньютона для электрона, движущегося по окружности под действием кулоновской силы, имеет вид Уравнение (208.1) содержит два неизвестных: r и v. Следовательно, существует бесчисленное множество значений радиуса и соответствующих ему значений скорости (а значит, и энергии), удовлетворяющих этому уравнению. Поэтому величины r, v (следовательно, и Е) могут меняться непрерывно, т. е. может испускаться любая, а не вполне определенная порция энергии. Тогда спектры атомов должны быть сплошными. В действительности же опыт показывает, что атомы имеют линейчатый спектр.

Из выражения (208.1) следует, что при r 10-10 м скорость движения электронов v 106 м/с, а ускорение v2/r = 1022 м/с2. Согласно электродинамике, ускоренно движущиеся электроны должны излучать электромагнитные волны и вследствие этого непрерывно терять энергию. В результате электроны будут приближаться к ядру и в конце концов упадут на него. Таким образом, атом Резерфорда оказывается неустойчивой системой, что опять-таки противоречит действительности. Преодоление возникших трудностей потребовало создания качественно новой — квантовой — теории атома.

§ 209. Линейчатый спектр атома водорода Швейцарский ученый И. Бальмер (1825—1898) подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра: где R = R'c = 3,291015 с-1 постоянная Ридберга.

В дальнейшем (в начале XX в.) в спектре атома водорода было обнаружено еще несколько серий. В ультрафиолетовой области спектра находится серия Лаймана:

В инфракрасной области спектра были также обнаружены: серия Пашена серия Брэкетасерия Пфундасерия Хэмфри

Все приведенные выше серии в спектре атома водорода могут быть описаны одной формулой, называемой обобщенной формулой Бальмера: m имеет в каждой данной серии постоянное значение, m = 1, 2, 3, 4, 5, 6 (определяет серию), n принимает целочисленные значения начиная с m + 1 (определяет отдельные линии этой серии)

Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн.В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантованные значения момента импульса, удовлетворяющие условию (210.1)

Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией равной разности энергий соответствующих стационарных состояний ( до и после излучения). (210.2) при < происходит излучение фотона, в противном случае – поглощение фотона.Набор возможных дискретных частот = ( — )/h квантовых переходов и определяет линейчатый спектр атома.

На рисунке изображены стационарные орбиты атома водорода согласно модели Бора, а также условно изображены переходы электрона с одной стационарной орбиты на другую, сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана, в видимой – серию Бальмера, в инфракрасной – серию Пашена. Наибольшей частоте кванта в серии Лаймана соответствует переход…

§ 211. Опыты Франка и Герца Немецкие физики Д. Франк и Г. Герц, изучая столкновения электронов с атомами газов (1913), экспериментально доказали дискретность значений энергии атомов.Опыты Франка и Герца показали, что электроны при столкновении с атомами передают им только определенные порции энергии. Следовательно, идея Бора о существовании в атомах стационарных состояний блестяще выдержала экспериментальную проверку.

§ 212. Спектр атома водорода по Бору Постулаты, выдвинутые Бором, позволили рассчитать спектр атома водорода и водородоподобных систем — систем, состоящих из ядра с зарядом Ze и одного электрона (например, ионы Не+, Li2+), а также теоретически вычислить постоянную Ридберга.Решая совместно уравнение (208.1) и уравнение (210.1), получим выражение для радиуса n-й стационарной орбиты:

Для атома водорода (Z = l) радиус первой орбиты электрона при n = 1, называемый первым боровским радиусом (а), равен Полная энергия электрона в водородоподобной системе складывается из его кинетической энергии и потенциальной энергии в электростатическом поле ядра

Учитывая квантованные для радиуса n-й стационарной орбиты значения (212.1), получим, что энергия электрона может принимать только следующие дозволенные дискретные значения: Из формулы (212.3) следует, что энергетические состояния атома образуют последовательность энергетических уровней, изменяющихся в зависимости от значения n.

Целое число n в выражении (212.3), определяющее энергетические уровни атома, называется главным квантовым числом. Энергетическое состояние с n = 1 является основным (нормальным) состоянием;состояния с n > 1 являются возбужденными. Энергетический уровень, соответствующий основному состоянию атома, называется основным (нормальным) уровнем; все остальные уровни являются возбужденными. Атом водорода обладает, таким образом, минимальной энергией (E1 = –13,55 эВ) при n = 1 и максимальной ( = 0) при n = ∞ (при удалении электрона из атома). Следовательно, значение = 0 соответствует ионизации атома (отрыву от него электрона).
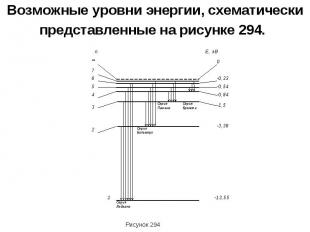
Возможные уровни энергии, схематически представленные на рисунке 294.

Согласно второму постулату Бора (см. (210.2)), при переходе атома водорода (Z = l) из стационарного состояния n с большей энергией в стационарное состояние m с меньшей энергией испускается квант

Спектр поглощения атома водорода является линейчатым, но содержит только серию Лаймана. Он также объясняется теорией Бора. Так как свободные атомы водорода обычно находятся в основном состоянии (стационарное состояние с наименьшей энергией при n = 1), то при сообщении атомам извне определенной энергии могут наблюдаться лишь переходы атомов из основного состояния в возбужденные (возникает серия Лаймана).Теория Бора была крупным шагом в развитии атомной физики и явилась важным этапом в создании квантовой механики.

Однако теория Бора обладает внутренними противоречиями (с одной стороны, применяет законы классической физики, а с другой — основывается на квантовых постулатах). Она рассмотрела спектры атома водорода и водородоподобных систем и вычислила частоты спектральных линий, однако не смогла объяснить их интенсивности и ответить на вопрос: почему совершаются те или иные переходы? Серьезным недостатком теории Бора была невозможность описания с ее помощью спектра атома гелия — одного из простейших атомов, непосредственно следующего за атомом водорода.