Презентация на тему: Основы ядерной физики

Основы ядерной физики

1.1. Строение атома. Понятие радиоактивности АТОМ – самая маленькая часть химического элемента, сохраняющая все его свойства, его размеры 10-8 см, состоит из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в виде электронного облака по электронным орбиталям. Атом в целом электронейтрален. ЭЛЕКТРОН – устойчивая элементарная частица с массой покоя, равной 0,000548 атомной единицы массы (а.е.м.) или 9,1×10-28 грамм. Электрон несет один элементарный отрицательный заряд электричества, равный 1,6×10-19 Кл, который в ядерной физике принят за единицу. Электроны перемещаются по эллиптическим орбитам, образуя электронную оболочку атома в виде облачка. Число электронных орбиталей колеблется от одной до семи соответственно группам химических элементов периодической системы Д.И. Менделеева, обозначаются буквами латинского алфавита.

ЯДРО – атомов состоят из положительно заряженных частиц – протонов, и нейтральных в электрическом отношении частиц – нейтронов, которые в целом называются нуклонами. Они находятся в постоянном движении и между ними действуют внутриядерные силы притяжения. Число протонов в ядре равно порядковому номеру элемента в периодической системе Д.И. Менделеева и обозначается в левом нижнем углу символа элемента буквой Z, а суммарное число протонов и нейтронов – в левом верхнем углу и обозначается буквой М, оно соответствует атомной массе химического элемента. Например: 235 92U.

Протон (p) – устойчивая элементарная частица с массой покоя равной 1,00758 а.е.м. (1,6725×10-24 г), примерно в 1840 раз больше массы покоя электрона, имеет один элементарный заряд, равный заряду электрона. Нейтрон (n) – электрически нейтральная частица, масса покоя которой равна массе покоя протона (1 а.е.м). Вследствие своей электрической нейтральности нейтрон не отклоняется под воздействием магнитного поля, не отталкивается атомным ядром, обладает большой проникающей способностью и биологической эффективностью. Таким образом, атомы химических элементов электронейтральны.
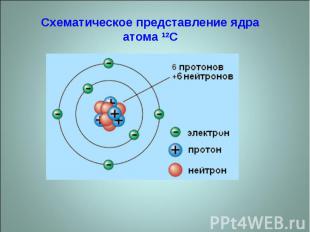
Схематическое представление ядра атома 12C

При сообщении электронам извне дополнительной энергии они могут переходить с одного энергетического уровня (орбиты) на другой или даже покидать пределы данного атома. Атомы, обладающие избытком энергии, называют возбужденными. Переход электронов с внешних орбит на внутренние сопровождается рентгеновским излучением. При сильных электрических воздействиях электроны вырываются из атома, удаляются за его пределы, а атом превращается в положительный ион, а атом, присоединивший один или несколько электронов – в отрицательный. Процесс образования ионов из нейтральных атомов называется ионизацией.
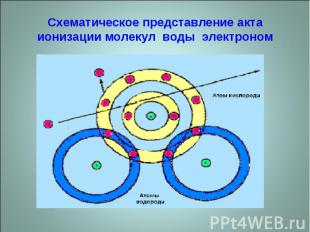
Схематическое представление акта ионизации молекул воды электроном

В природе большинство химических элементов состоит из смеси атомов с различным числом нейтронов, но с постоянным числом протонов – такие атомы называются изотопами. Атомы химического элемента с одинаковым массовым числом, но ядра которых находятся в различном энергетическом состоянии, называются изомерами. Ядра всех изотопов химических элементов принято называть нуклидами. Например: элемент уран состоит из изотопов 238U – 98,5% и 235U – 1,5%. Изотопы подразделяются на 2 группы: стабильные и радиоактивные. Ядра атомов, обладающих радиоактивностью – радионуклиды (РН).

РАДИОАКТИВНОСТЬ – превращение атомных ядер одних химических элементов в ядра других химических элементов с выделением энергии в виде электромагнитного излучения (гамма- и рентгеновское излучения) и корпускулярных частиц (альфа-, бета-, нейтронное, позитронное излучения). Радиоактивные излучения, происходящие в природе без внешнего воздействия, называются естественной радиоактивностью, а в искусственно полученных под воздействием альфа-, нейтронного излучений веществах (через ядерные реакции) – искусственной или наведенной радиоактивностью.

Виды ИИ1. Электромагнитные излучениярентгеновское;гамма-излучение.2. Корпускулярные излучениябета-излучение (электронное и позитронное);альфа-излучение;нейтронное- излучение;позитронное- излучение;протонное излучение;излучение тяжелых ядер распада;кластерное излучение (С-14).

В настоящее время известны 3 естественных радиоактивных семейства: 1. Урана-радия – 238U и 226Ra, которые через 8 альфа- и 6 бета-распадов превращаются в стабильный изотоп свинца –208Pb2. Тория – 232Th, который через 6 альфа- и 4 бета-распадов превращается в стабильный изотоп свинца. 3. Актиния-урана – 235U и 235Ac, которые в результате 7 альфа- и 4 бета- распадов также превращаются в стабильный изотоп свинца

Скорость ядерных превращений характеризуется активностью – числом ядерных превращений в единицу времени. В системе СИ за единицу активности радионуклидов принимается единица беккерель (Бк), равная одному ядерному превращению в 1 секунду. 1 Бк = 1 расп./с Внесистемной единицей активности радионуклидов является единица Кюри (Ки) – это такое количество радиоактивных веществ, в котором число радиоактив-ных превращений в 1 секунду равно 3,7 × 1010. Эта величина соответствует радиоактивности 1 г радия. 1 Ки = 3,7 × 1010 расп./с = 3,7 × 1010 Бк Применяются также дольные и кратные величины
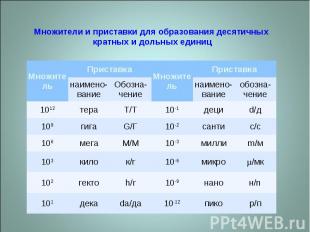
Множители и приставки для образования десятичных кратных и дольных единиц

Единицами удельной активности или концентрации, т.е. активности на единицу массы или объема являются следующие величины: Ки/мл, Ки/г, Бк/г, Бк/мл и др. Единицей гамма-активности радиоактивных источников является эквивалент 1 мг радия. Миллиграмм эквивалент радия (мг-экв. радия) равен активности любого радиоактивного препарата, гамма-излучение которого создает при одинаковых условиях такую же мощность экспозиционной дозы, как гамма-излучение 1 мг радия Государственного эталона при платиновом фильтре 0,5 см на расстоянии 1 см от источника. Точечный источник в 1 мг (1 мКи) радия создает мощность экспозиционной дозы 8,4 Р/ч. Эта величина называется ионизационной гамма-постоянной радия и обозначается символом Кγ.