Презентация на тему: Теория нормального горения

Теория нормального горенияЛекция 5 по теории горения и взрыва ДБЖ-09
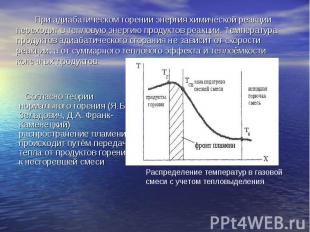
При адиабатическом горении энергия химической реакции переходит в тепловую энергию продуктов реакции. Температура продуктов адиабатического сгорания не зависит от скорости реакции, а от суммарного теплового эффекта и теплоёмкости конечных продуктов. Согласно теории нормального горения (Я.Б. Зельдович, Д.А. Франк-Каменецкий) распространение пламени происходит путём передачи тепла от продуктов горения к несгоревшей смеси Распределение температур в газовой смеси с учетом тепловыделения

Химическая реакция сосредоточена в узкой зоне и уравнение теплопроводности в зоне подогрева выглядит: с·ρ·dT/dt=η·d2T/dx2 μ=η/(с·ρ) Скорость горения: U·dt/dx=μ·d2T/dx2Адиабатическая температура горения: Т=Т0+(TВ-Т0)·e-U·x/μТемпература воспламенения горючего вещества: (ТВ-Т0)/(Т-Т0)=e-U·x/μ

Важной характеристикой является зона прогрева и толщина прогрева: если зона прогрева и зона химической, то U·x/μ=1; x=μ/Uтолщина зоны прогрева обратно пропорциональна скорости горения, если скорость горения 0,1/с, то толщина зоны прогрева равна 10-2 см, а если скорость горения 10 м/с, а толщина зоны прогрева 10-4 см Толщина зоны прогрева зависит от времени протекания химической реакции: x=U·t t – время протекания химической реакциитогда скорость горения U=√μ·Ф/t

Количество тепла подводимого путем теплопроводности описывается уравнением: Q=λ·(T-T0)·δλ – коэффициент теплопроводности; δ – ширина фронта пламени.Тепло расходуемое на нагрев свежей смеси от Т0 до ТQ=U·c·ρ(T-T0)с – удельная теплоемкость; ρ – плотность смеси.Скорость распространения пламени, при условии равенства скорости подачи газа: U=λ/c·ρ·δКоэффициент температуропроводностиa=λ/c·ρ

Согласно кинетической теории газов время химической реакции: t=λ·γ/cгде λ – длина свободного пробега молекулы; с – скорость теплового движения молекул (численно равна скорости звука); γ – число столкновений молекул, обладающих энергией активации а температуропроводность: μ=⅓ λ·с тогда скорость распространения пламени: U=c/√γ·√Ф/3если √γ>1, то скорость распространения пламени намного меньше скорости звука. Скорость горения зависит от температуры, поэтому скорость распространения пламени: U=b exp(-E/RT)b – показатель зависящий от свойств смеси Предельное значение скорости пламени определяется:Uпред =Umax√e

Уравнение теплового баланса:сР·ρ·dT/dt=U·cP·ρ·dT/dt+η·d2T/dx2+Fгде сР·ρ·dT/dt – изменение температуры в какой-то точке в единице объёма; U·cP·ρ·dT/dt – тепло, которое вносит газ, обладающий температурой Т и втекающий в зону реакции; η·d2T/dx2 - тепло которое образуется в результате теплопроводности вещества в зоне горения; F – количество тепла, выделяющееся в единицу времени и единицу объема Упрощения: при стационарном режиме сР·ρ·dT/dt =0зона реакции чрезвычайно тонкая, поэтому пренебрегаем количеством тепла которое вносит протекающий через него газ: U·cP·ρ·dT/dt =0

Тогда упрощенный вид уравнения теплового баланса будет выглядеть: η·d2T/dx2+F=0 Вводим дополнительные переменные:φ=d2T/dx2dx=dT/φd2T/dx2=φ·dφТогда уравнение теплового баланса:η·φ·dφ=-F·dT Полученное уравнение теплового баланса интегрируем по зоне горенияот Т0 до Т: Для теплового потока в зоне горения:

Скорость горения определяется теплопроводностью газа и объемной скоростью тепловыделения. Концентрацию продуктов реакции рассчитывают по уравнению:с=(Тг-Т)/(Тг-Т0) Массовая скорость принимает вид: где n – порядковый номер химической реакции, ωТ – объёмная скоростьхимической реакции при температуре горения. Массовая скорость горения и давления взаимосвязаны уравнением: