Презентация на тему: Молекулярная физика

МОЛЕКУЛЯРНАЯ ФИЗИКА
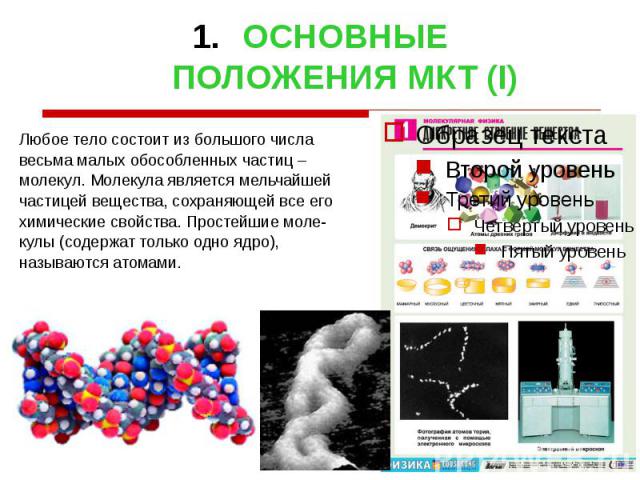
ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ (I) Любое тело состоит из большого числа весьма малых обособленных частиц – молекул. Молекула является мельчайшей частицей вещества, сохраняющей все его химические свойства. Простейшие моле- кулы (содержат только одно ядро), называются атомами.
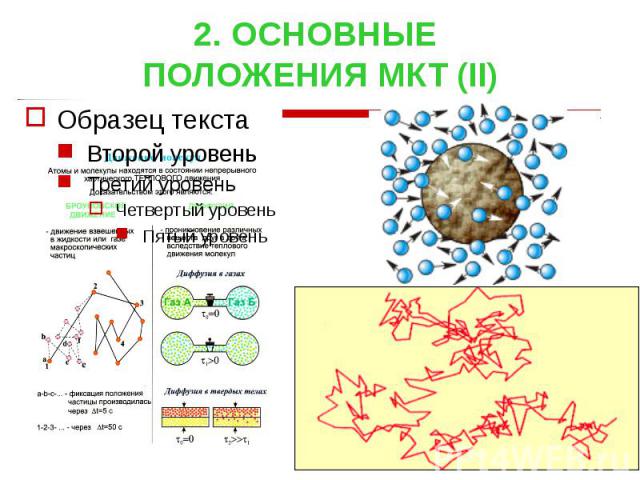
2. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ (II)
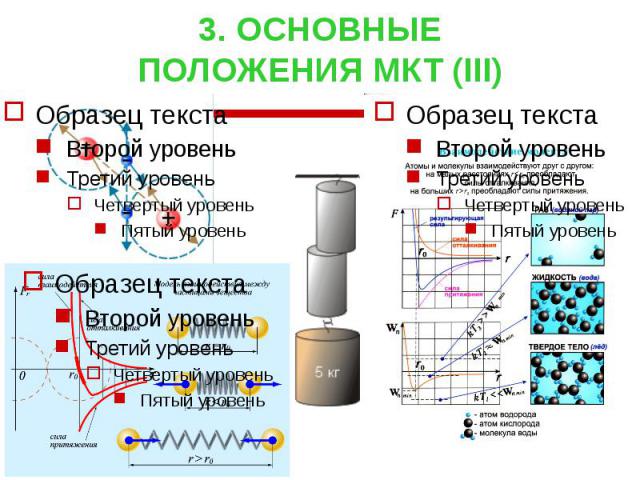
3. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ (III)

4. КОЛИЧЕСТВО ВЕЩЕСТВА Амедео Авогадро 1776-1856 Итальянский физик и химик

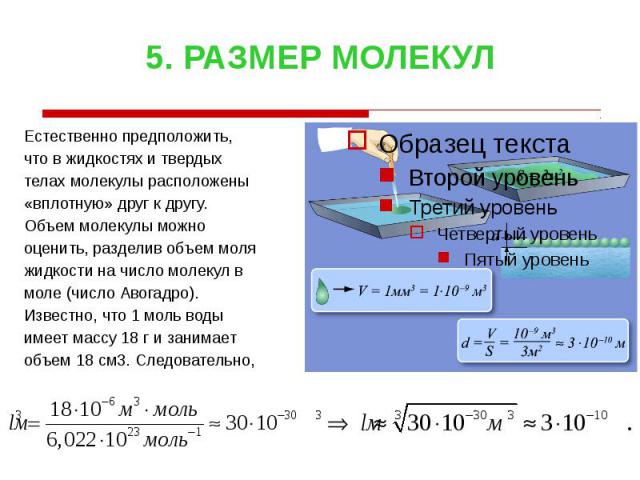
5. РАЗМЕР МОЛЕКУЛ Естественно предположить, что в жидкостях и твердых телах молекулы расположены «вплотную» друг к другу. Объем молекулы можно оценить, разделив объем моля жидкости на число молекул в моле (число Авогадро). Известно, что 1 моль воды имеет массу 18 г и занимает объем 18 см3. Следовательно,

6. СТАТИСТИЧЕСКИЙ И ТЕРМОДИНАМИЧЕСКИЙ МЕТОДЫ Существуют два способа описания процессов, происходящих в макро- скопических телах (телах, состоящих из большого числа частиц) – статистический и термодинамический. Статистический метод изучает свойства макроскопических тел исходя из свойств образующих тело частиц и взаимодействий между ними. Свойства тел, наблюдаемые на опыте, объясняются как усред- ненный результат действия отдельных молекул. Термодина- мический метод изучает свойства тел, не вдаваясь в их микроско- пическую структуру, а опираясь на фундаментальные законы (начала термодинамики), уста- новленные обобщением экспе- риментальных фактов.

7. ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА. ПАРАМЕТРЫ СОСТОЯНИЯ Термодинамической системой называется совокупность макроскопических тел, которые могут обмениваться энергией между собой и окружающей средой. Термодинамическая система может находиться в различных состояниях, различающихся температурой, давлением, объемом, плотностью… Подобные величины, характерезу- ющие состояние системы, называ- ются параметрами состояниями. Термодинамические системы, которые не обмениваются с внешней средой ни энергией, ни веществом называ- ются замкнутыми (изолированными).
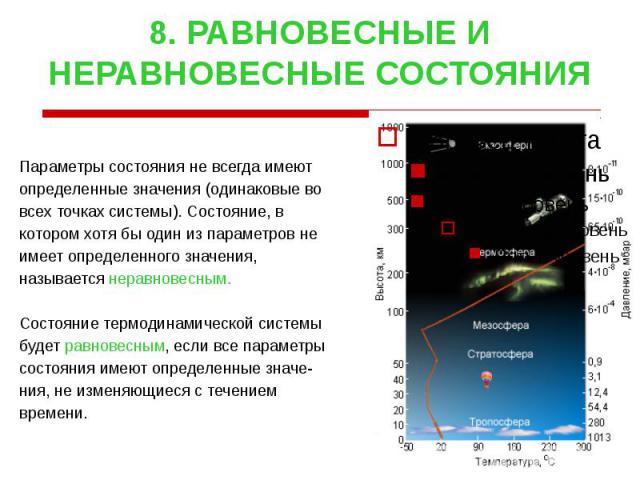
8. РАВНОВЕСНЫЕ И НЕРАВНОВЕСНЫЕ СОСТОЯНИЯ Параметры состояния не всегда имеют определенные значения (одинаковые во всех точках системы). Состояние, в котором хотя бы один из параметров не имеет определенного значения, называется неравновесным. Состояние термодинамической системы будет равновесным, если все параметры cостояния имеют определенные значе- ния, не изменяющиеся с течением времени.
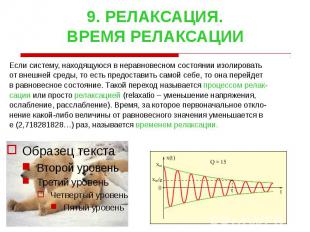
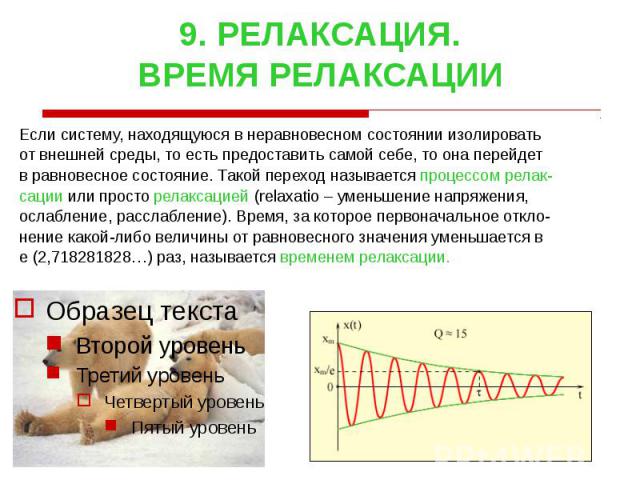
9. РЕЛАКСАЦИЯ. ВРЕМЯ РЕЛАКСАЦИИ Если систему, находящуюся в неравновесном состоянии изолировать от внешней среды, то есть предоставить самой себе, то она перейдет в равновесное состояние. Такой переход называется процессом релак- сации или просто релаксацией (relaxatio – уменьшение напряжения, ослабление, расслабление). Время, за которое первоначальное откло- нение какой-либо величины от равновесного значения уменьшается в e (2,718281828…) раз, называется временем релаксации.

10. РАВНОВЕСНЫЕ ПРОЦЕССЫ Термодинамическим процессом называется переход системы из одного состояния в другое. Такой переход всегда связан с нарушением равновесия системы. Например, при сжатии газа давление в первую очередь возрастет вблизи поршня – равновесие нарушится. Нарушение равновесия будет тем значительнее, чем быстрее перемещать поршень. Если двигать поршень очень медленно, то равновесие нару- шается незначительно и давление в разных точках мало отличается от равновесного для данного объема газа. В пределе, при бесконечно медленном сжатии процесс окажется состоящим из последовательности равновесных состояний. Такой процесс называется равновесным или квазистатическим.

11. ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ При изменении направления равновесного процесса (например, замене сжатия газа расширением) система будет проходить через те же равновесные состояния, что и при прямом ходе, но в обратной последова- тельности. Поэтому равновесные процессы называют также обратимыми процессами. Равновесное состояние можно изобразить точкой на координатной (фазовой) плоскос- ти, а равновесный процесс – кривой линией. Неравновесное состояние и процесс не могут быть изображенными таким способом. Неравновесные процессы являются необратимыми процессами.
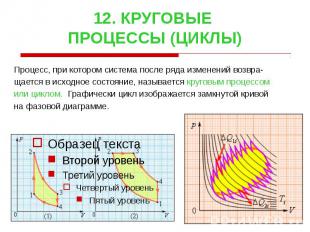
12. КРУГОВЫЕ ПРОЦЕССЫ (ЦИКЛЫ) Процесс, при котором система после ряда изменений возвра- щается в исходное состояние, называется круговым процессом или циклом. Графически цикл изображается замкнутой кривой на фазовой диаграмме.

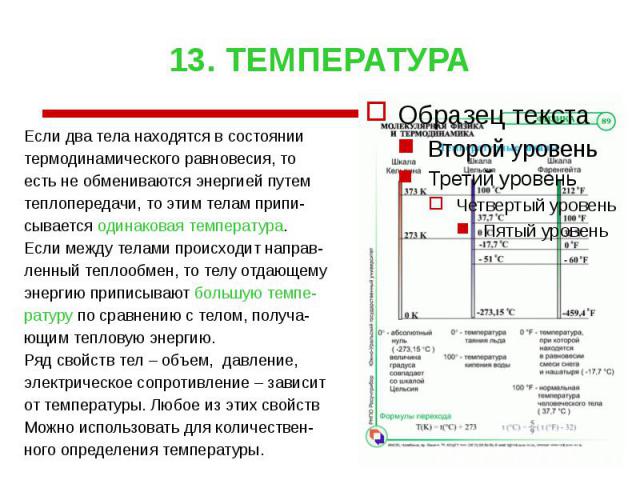
13. ТЕМПЕРАТУРА Если два тела находятся в состоянии термодинамического равновесия, то есть не обмениваются энергией путем теплопередачи, то этим телам припи- сывается одинаковая температура. Если между телами происходит направ- ленный теплообмен, то телу отдающему энергию приписывают большую темпе- ратуру по сравнению с телом, получа- ющим тепловую энергию. Ряд свойств тел – объем, давление, электрическое сопротивление – зависит от температуры. Любое из этих свойств Можно использовать для количествен- ного определения температуры.

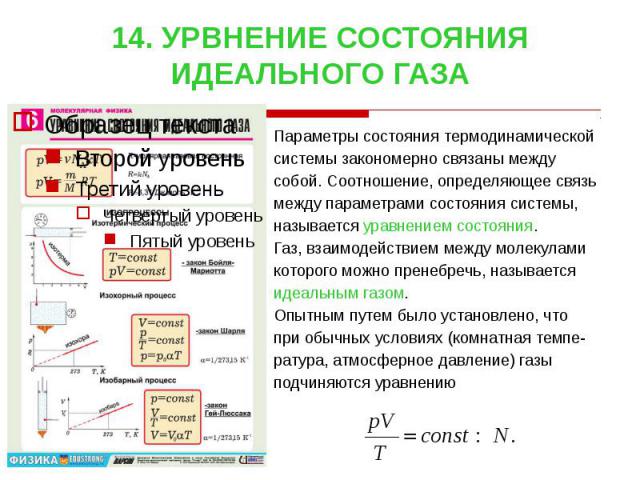
14. УРВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА Параметры состояния термодинамической системы закономерно связаны между собой. Соотношение, определяющее связь между параметрами состояния системы, называется уравнением состояния. Газ, взаимодействием между молекулами которого можно пренебречь, называется идеальным газом. Опытным путем было установлено, что при обычных условиях (комнатная темпе- ратура, атмосферное давление) газы подчиняются уравнению

15. ЗАКОН ШАРЛЯ
16. ЗАКОН БОЙЛЯ-МАРИОТТА

17. ЗАКОН ГЕЙ-ЛЮССАКА

18. ЗАКОН ДАЛЬТОНА

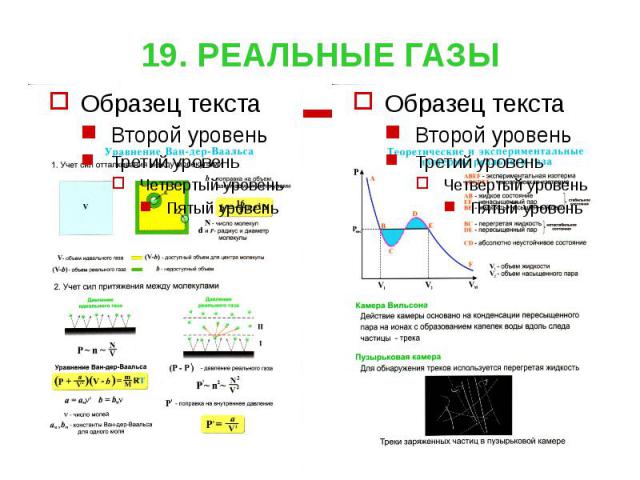
19. РЕАЛЬНЫЕ ГАЗЫ
§2. СТАТИСТИЧЕСКАЯ ФИЗИКА

1.ЧИСЛО МОЛЕКУЛ, ДВИЖУЩИХСЯ В ЗАДАННОМ НАПРАВЛЕНИИ Хаотичность движения молекул приводит к тому, что распределение молекул по направлениям является равномерным. Тогда, количество молекул, движущихся в пределах бесконечно малого телесного угла

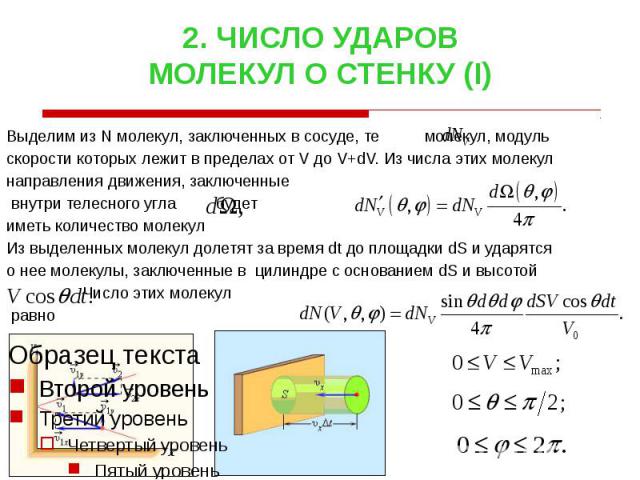
2. ЧИСЛО УДАРОВ МОЛЕКУЛ О СТЕНКУ (I) Выделим из N молекул, заключенных в сосуде, те молекул, модуль скорости которых лежит в пределах от V до V+dV. Из числа этих молекул направления движения, заключенные внутри телесного угла будет иметь количество молекул Из выделенных молекул долетят за время dt до площадки dS и ударятся о нее молекулы, заключенные в цилиндре с основанием dS и высотой Число этих молекул равно

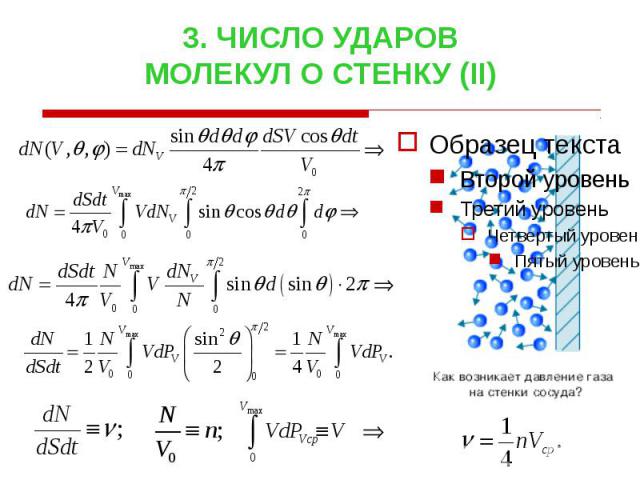
3. ЧИСЛО УДАРОВ МОЛЕКУЛ О СТЕНКУ (II)

4. ДАВЛЕНИЕ ГАЗА НА СТЕНКУ (I) Стенки сосуда, в котором заключен газ, подвергаются непрерывной бомбардировке молекулами. Если предположить, что молекулы отска- кивают от стенки по закону зеркального отражения и модуль скорости молекулы не изменяется, то импульс, сообщаемый стенке молекулой при ударе равен Импульс, передаваемый поверхности dS за время dt, молекулами движущимися в пределах телесного угла со скоро- стью в интервале от V до V+dV, будет равен

5. ДАВЛЕНИЕ ГАЗА НА СТЕНКУ (II) Проинтегрируем выражение для импульса по всем возможным скоростям и направ- лениям движения молекул:

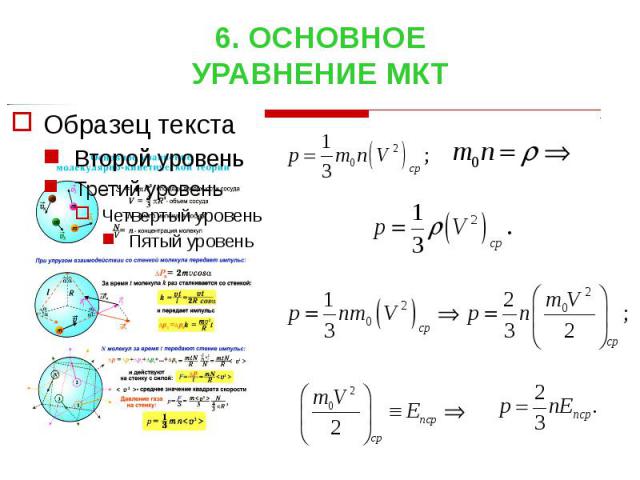
6. ОСНОВНОЕ УРАВНЕНИЕ МКТ

7. СРЕДНЯЯ ЭНЕРГИЯ ПОСТУПАТЕЛЬНОГО ДВИЖЕНИЯ

8. СРЕДНЯЯ КВАДРАТИЧНАЯ СКОРОСТЬ

9. ЗАКОН РАВНОРАСПРЕДЕЛЕНИЯ
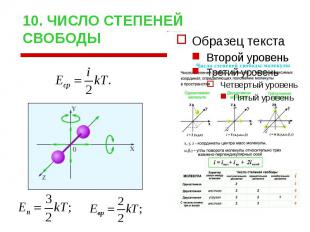
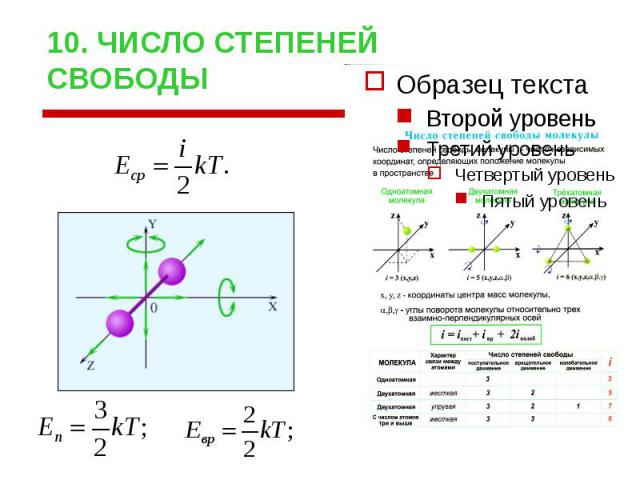
10. ЧИСЛО СТЕПЕНЕЙ СВОБОДЫ

11. ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА

12. МОЛЯРНАЯ ТЕПЛОЕМКОСТЬ ИДЕАЛЬНОГО ГАЗА