Презентация на тему: Химия электролиз

Урок -практикум по решению задач. Тема:«Решение задач на законы электролиза" Разработала: Учитель химии: Дунаева Е.Д. Идея урока: Развитие принципов политехнизации. Девиз: “Чтобы познать, нужно научиться наблюдать!” Цели: -использовать свои знания для решения задач; -расширить кругозор учащихся и повысить познавательный интерес к изучению химии и физики; -способствовать осознанию материального единства явлений; -развивать логическое мышление учащихся посредством анализа, сравнения, обобщения изучаемого материала; Использование новых информационных технологий: -Компьютеры; -Мультимедиа-проектор; -Экран. -Обучающая компьютерная презентация -слайды “Модель электролиза расплава и растворовсолей Видеофрагмент “Электролиз”. 1CD Химия 8-11кл. Кирилл и Мефодий,1003г 900igr.net
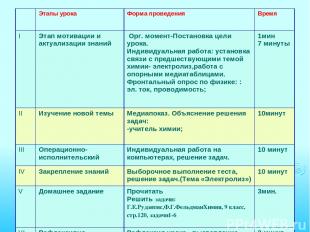
Этапы урока Форма проведения Время I Этап мотивации и актуализации знаний Орг. момент-Постановка цели урока. Индивидуальная работа: установка связи с предшествующими темой химии- электролиз,работа с опорными медиатаблицами. Фронтальный опрос по физике: : эл. ток, проводимость; 1мин 7 минуты II Изучение новой темы Медиапоказ. Объяснение решения задач: -учитель химии; 10минут III Операционно-исполнительский Индивидуальная работа на компьютерах, решение задач. 10 минут IV Закрепление знаний Выборочное выполнение теста, решение задач.(Тема «Электролиз») 10 минут V Домашнее задание Прочитать Решить задачи: Г.Е.Рудзитис,Ф.Г.ФельдманХимия, 9 класс, стр.120, задачи1-6 3мин. VI Рефлексивно-оценочный Рефлексия урока , выставление оценок 3 минут

I.Этап актуализации знаний Модель электролиза раствора СuCL2 Катод Анод

Выводы по актуализации знаний к теме «Электролиз» Совокупность окислительно-восстановительных реакций, которые протекают на электродах в растворах или расплавах электролитов при пропускании через них электрического тока, называют электролизом. На катоде(-) источника тока происходит процесс передачи электронов катионам из раствора или расплава, поэтому катод является “восстановителем”. На аноде(+) происходит отдача электронов анионами, поэтому анод является “окислителем”. При электролизе, как на аноде, так и на катоде могут происходить конкурирующие процессы. Правила при составлении электролиза: 1. Процессы на аноде- могут образовываться следующие продукты: а) при электролизе растворов, содержащих в своем составе анионы F+, SO42-, NO3-, PO43-, а также растворов щелочей выделяется кислород; б) при окислении анионов бескислородных кислот Cl -, Br -, I -, выделяются соответственно хлор, бром, йод; 2. Процессы на катоде- могут образовываться следующие продукты: а) если ионы металлов, расположены в ряду напряжений левее Al3+, выделяется водород; б)если ион расположен в ряду напряжений правее водорода, то на катоде выделяется металл. в)При электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений между Al3+ и H+ , на катоде могут протекать конкурирующие процессы как восстановления катионов, так и выделения водорода. К+ , Са 2+, Na+, Mg2+, AL3+, Zn2+, Fe2+, Ni2+, Sn2+,Pb2+,H+,Cu2+,Hg2+,Ag+,Pt4+,Au3+,

Задание: ЕГЭ В-4 -2006г. 1.Составить уравнения ОВР данных веществ на электродах. 2.Установите соответствие между формулой вещества и продуктами электролиза его водного раствора на инертных электродах. Формула вещества Продукты электролиза хлорид алюминия гидроксид рубидия нитрат ртути(II) хлорид золота(III) а) металл, галоген б) гидроксид металла, хлор, водород в) металл, кислород г) водород, галоген д )водород, кислород е)металл, кислота, кислород

Фронтальный опрос. В каких состояниях может находится вещество? На какие группы делятся вещества по проводимости электрического тока? Какая проводимость в металлах? Чем обусловлена собственная проводимость полупроводников? Какая проводимость в газах? Проводимости каких веществ мы еще не рассматривали?

II. Этап изучение нового материала Пример решения задач по химии. Условие задачи: При электролизе водного раствора бромида металла, образующего однозарядный катион, содержащий 41,5г. этой соли выделилось 4,48л.Н2 при н.у. Определите бромид какого металла взяли? Решение. 1.Логическое рассуждение. Вопрос: у кого какие предложения, предположения по условию задачи? Подсказки (Если катион однозарядный, то…….Если одним из продуктов реакции является водород……) Вспомним правила электролиза, см. слайд. 2.Составление уравнения реакции: 2МеBr+2Н2О= Н2+ Br2 +2МеОН 41,5г. 4,48л. 3.Поставляем данные на уравнение реакции^ 2МеBr+2Н2О= Н2+ Br2 +2МеОН х 22,4л/m 4. Находим по формуле количество вещества водорода: n= V/Vm,n=4,48л./ 22,4л/m=0,2моль 5. Составляем соотношение молей по уравнению реакции: если на образование 1моля Н2 нужно 2 моли соли МеBr, то на 0,2моли газа нужно соответственно 0,4моли соли. Пропорция: 2-----1 0,4-----0,2 6.Находим молярную массу соли по формуле: М=m/n,значит М= 41,5г/ 0,4моль=103г/м. 7. Находим атомную массу металла: 103- 80=23, это металл-Na Ответ: NaBr

Пример решения задач по физике Итак, при электролизе на катодах происходит выделение вещества. От чего зависит масса вещества, выделяющегося за определенный промежуток времени? Масса вещества, выделившегося на электроде равна: m = moi • Ni , где moi – масса одного иона, Ni – число ионов, достигших электродов. Из курса физики и химии мы уже энаем: moi = M/NА, где М – молярная масса, NА – число Авогадро. Ni = q/qoi, но qoi = n · e , q = I • t, где n – валентность, е – заряд электрона, I – сила тока, t – время Получаем m = M/NA · I t / n · e , или m = M/NA· n • e • I t Если введем постоянную k = M/NA· n • e , то получаем m = k• I t , где k – электрохимический эквивалент вещества, коэффициент пропорциональности, зависящий от природы вещества. Вывод: масса вещества, выделившегося на электроде за время t при прохождении электрического тока, пропорциональна силе тока и времени. Это утверждение, полученное нами теоретически, впервые было установлено экспериментально Фарадеем, носит название закона электролиза Фарадея.

Майкл Фарадей (1711 – 1867) – английский физик, основоположник учения об электрических и магнитных полях. М.Фарадей родился в предместье Лондона в семье кузнеца. Свое образование он получил в начальной школе. В возрасте 13 лет ему пришлось поступить учеником в переплетную мастерскую. Увлекшись чтением книг, особенно по электричеству и химии, Фарадей начинает сам проделывать описанные в них опыты. И в 1813 году (22 года) он был принят на работу в лабораторию известного английского химика Г.Дэви. Так сказал о нем Столетов: “Никогда со времени Галилея свет не видел стольких поразительных и разнообразных открытий, вышедших из одной головы, и едва мы скоро увидим другого Фарадея…

Решение задач по физике. Задача: При никелировании детали в течении 50 минут сила тока, проходящего через ванну, была равна 2 А. Какова масса, выделившегося вещества на детали, если электрохимический эквивалент никеля k = 3 · 10 в степени – 7 кг/Кл?

Применение электролиза. «Любое научное открытие интересно только тогда, когда находит практическое применение» 1.Электролиз растворов электролитов проводить энергетически выгоднее, чем расплавов, так как электролиты – соли и щелочи – плавятся при очень высоких температурах. Электролиз широко используется для получения наиболее активных металлов (щелочных, щелочно-земельных, алюминия, магния), некоторых активных неметаллов (фтор, хлор) и сложных веществ (гидроксида натрия и калия). 2.Для очистки металлов от примесей (рафинирование). Так полученную из руды неочищенную медь отливают в форме толстых листов, которые помещают в ванну в качестве анодов. При электролизе медь анода будет растворяться, примеси выпадают на дно, на катоде, сделанном из особо чистой меди будет оседать чистая медь.Дорого обходится такая рафинированная медь с примесью всего 0,1% и менее, но все затраты покрываются стоимостью извлеченных из нее серебра, золота, селена, теллура. 3.Электролитическим путем покрывают поверхность одного металла тонким слоем другого ( никелем, хромом, оловом, золотом и т.д) для защиты поверхности от коррозии. 4.Если на поверхность металла нанести слой графита, то электролизом можно получить точную копию с рельефной поверхности. Это гальфанопластика, открыт русским ученым Б.Якоби, который в 1836 г применил этот способ для изготовления полых фигур в Исааковском соборе в Санк-Петербурге.

III этап. Операционно- исполнительский .Индивидуальная работа с компьютерной программой по решению задач. Инструктивная карта по работе с обучающей программой 1С Образовательная коллекция. Самоучитель. Химия для всех. Решение задач Открываем раздел «Теоретическая химия» Находим тему «Окислительно- восстановительные реакции» По теме «Электролиз» решаем задачи:10060112,10060128, 10061401, В 09062252

IV этап. Закрепление знаний Тест: 1. При электролитической диссоциации в растворе электролита присутствуют: А) молекулы, Б) ионы, В) гидратированные ионы. 2. Какая проводимость наблюдается в жидкостях? А) электронная, Б) ионная, В) электронно-ионная 4. Чем отличается проводимость электролитов от проводимости в металлах? А) ни чем, Б) в электролитах ионы, в металлах ионы и электроны, В) в электролитах – ионы, в металлах – электроны. 5. Каким ученым связано развитие гальванотехники: А) М.Фарадей, Б) Б.Якоби, В) С.Аррениус 6. Задача. При силе тока 1,6 А на катоде выделилась медь массой 0,316 г за 10 минут. Найдите значение k меди.

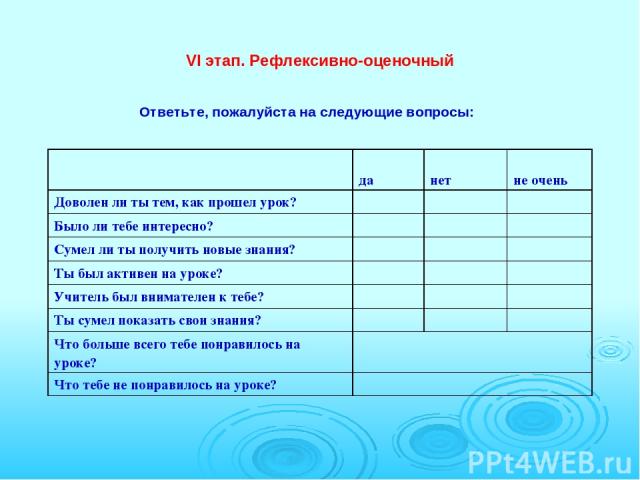
VI этап. Рефлексивно-оценочный Ответьте, пожалуйста на следующие вопросы: да нет не очень Доволен ли ты тем, как прошел урок? Было ли тебе интересно? Сумел ли ты получить новые знания? Ты был активен на уроке? Учитель был внимателен к тебе? Ты сумел показать свои знания? Что больше всего тебе понравилось на уроке? Что тебе не понравилось на уроке?